
【题目】在锌与盐酸反应的实验中,某同学得到的结果如下表所示:
锌的质量/g | 锌的形状 | 温度/℃ | 锌完全溶解的时间/s | |
A | 2 | 薄片 | 5 | 400 |
B | 2 | 薄片 | 15 | 200 |
C | 2 | 薄片 | 25 | 100 |
D | 2 | 薄片 | 35 | t1 |
E | 2 | 颗粒 | 15 | t2 |
F | 2 | 粉末 | 15 | t3 |
G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
(1)反应的离子方程式是 , 该反应为反应(填“放热”或“吸热”).
(2)t1=s,完成下列时间对温度的曲线图(纵轴表示时间,横轴表示温度) .
(3)利用所画的曲线图和相关数据,可得出该反应中温度影响反应速率的规律是 .
(4)t1(填“>”或“<”)t4 , 原因是 .
t2t3(填“>”或“<”),原因是 .
【答案】
(1)Zn+2H+═Zn2++H2↑;放热
(2)50;
(3)温度每升高10℃,反应速率加快到原来的2倍
(4)>;G组中可形成Cu﹣Zn原电池,发生原电池反应,反应速率加快;>;F组中锌为粉末状,表面积较大,反应速率较快
【解析】解:(1.)Zn与盐酸反应生成氯化锌和氢气,离子反应为Zn+2H+═Zn2++H2↑,放出热量,为放热反应,所以答案是:Zn+2H+═Zn2++H2↑; 放热;
(2.)由A、B、C、D中的实验可知,温度每升高10℃时,时间减少一半,则t1=100s× ![]() =50s,时间对温度的曲线图为
=50s,时间对温度的曲线图为  ,所以答案是:50;
,所以答案是:50;  ;
;
(3.)该反应中温度影响反应速率的规律是温度每升高10℃,反应速率加快到原来的2倍所以答案是:温度每升高10℃,反应速率加快到原来的2倍;
(4.)G组中可形成Cu﹣Zn原电池,发生原电池反应,反应速率加快,则t1>t4;F组中锌为粉末状,表面积较大,反应速率较快,则t2>t3 , 所以答案是:>;G组中可形成Cu﹣Zn原电池,发生原电池反应,反应速率加快;>;F组中锌为粉末状,表面积较大,反应速率较快.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列关于甲、乙、丙、丁四种有机物的说法正确的是
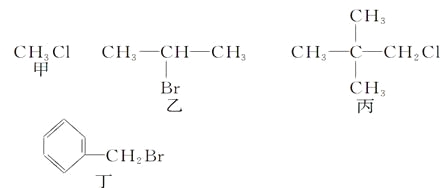
A. 甲、乙、丙、丁中分别加入氯水,均有红棕色液体生成
B. 甲、乙、丙、丁中加入NaOH溶液共热,然后加入稀硝酸调至溶液呈酸性,再滴入AgNO3溶液,均有沉淀生成
C. 甲、乙、丙、丁中加入NaOH的醇溶液共热,然后加入稀硝酸调至溶液呈酸性,再滴入AgNO3溶液,均有沉淀生成
D. 乙发生消去反应得到两种烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列说法错误的是( )
A.燃煤中加入生石灰可减少温室气体的排放
B.用纯碱溶液除油污,加热可提高去污能力
C.我国北斗导航系统所用的芯片中含高纯硅
D.医用护目镜片的主要成分属于有机高分子材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生活中有着广泛的应用,下列对应关系错误的是
物质性质 | 实际应用 | |
A | Al2(SO4)3和小苏打反应 | 泡沫灭火器灭火 |
B | 元素硅处于金属与非金属分界线 | 单质硅常用作光导纤维 |
C | 常温下,钠钾合金熔点低且导热性好 | 原子反应堆导热剂 |
D | HF与SiO2反应 | 氢氟酸在玻璃器皿上刻蚀标记 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某化学兴趣小组的同学学习元素周期律时设计的两套实验方案.
(1)【实验一】实验步骤如下:
实验序号 | 实验步骤 |
① | 向新制的Na2S溶液中滴加新制的氯水 |
② | 将镁条投入1mol/L的稀盐酸中 |
③ | 将铝条投入1mol/L的稀盐酸中 |
(i)设计该实验方案的目的是:探究同周期元素的 .
(ii)实验①的现象是 ,反应的化学方程式是 .
(2)【实验二】为验证Cl2、Br2的非金属性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)实验步骤如图.
(iii)试剂A是 ;试剂B是 ;试剂C是 .
(iv)试剂C在实验中所起的作用是 ,
加入C振荡、静置后看到的现象是: .
以上反应可以证明Cl2的非金属性 (填“强于”或“弱于”)Br2的非金属性,反应的离子方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.s区、d区、ds区都是金属元素
B.p区都是主族元素
C.所有族中IIIB中元素种类最多
D.最外层电子数为2的元素都分布在s区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于卤素及其化合物的叙述错误的是 ( )
A. 非金属性:F>Cl>Br>I
B. 单质氧化性:F2>Cl2>Br2>I2
C. 氢化物稳定性:HF>HCl>HBr>HI
D. 沸点:F2>Cl2>Br2>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3﹣+3HSO3﹣=3SO42﹣+Cl﹣+3H+ , 已知该反应的速率随溶液酸性的增强而加快.如图为用ClO3﹣在单位时间内的物质的量浓度的变化来表示该反应速率的速率﹣时间图象.下列说法不正确的是( ) 
A.反应开始时速率增大可能是c(H+)增大引起的
B.纵坐标为v(H+)的速率﹣时间曲线与图中曲线不能完全重合
C.后期反应速率下降的主要原因是反应物浓度减小
D.图中阴影部分“面积”为t1至t2时间内的ClO3﹣的物质的量的减小值
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com