
分析 依据n=$\frac{m}{M}$=cV,结合;氯化钠为强电解质,在水溶液中完全电离,1mol氯化钠电离产生1mol钠离子和1mol氯离子解答.
解答 解:58.5gNaCl中氯化钠的物质的量为:$\frac{58.5g}{58.5g/mol}$=1mol,含有1mol钠离子,1mol氯离子,溶于水配成2LNaCl溶液物质的量浓度为:$\frac{1mol}{2L}$=0.5mol/L,氯化钠为强电解质,在水溶液中完全电离,1mol氯化钠电离产生1mol钠离子和1mol氯离子,个数都是NA,
故答案为:1;0.5mol/L;NA;NA.
点评 本题考查了物质的量有关计算,熟悉以物质的量为核心的计算公式是解题关键,题目难度不大,侧重考查学生对基础知识的掌握熟练程度.


科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的热稳定性:Y>Z | |
| B. | Y元素的氧化物对应的水化物一定是强酸 | |
| C. | M与R可形成含非极性键的化合物 | |
| D. | 固体X2Y3可在水溶液中制取 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu 溶于稀 HNO3:Cu+2H++NO3-═Cu2++NO2↑+H2O | |
| B. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 用CH3COOH溶解 CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | FeCl3溶液与Cu反应:2Fe3++Cu═2Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
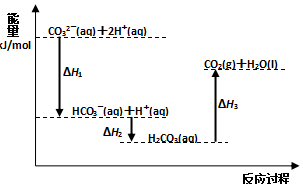
| A. | 反应HCO3-(aq)+H+(aq)=CO2(g)+H2O(l) 为放热反应 | |
| B. | CO32-(aq)+2H+(aq)=CO2(g)+H2O(l)△H=(△H1+△H2+△H3) | |
| C. | △H1>△H2△H2<△H3 | |
| D. | H2CO3(aq)=CO2(g)+H2O(l),若使用催化剂,则△H3变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuFeS2中硫的化合价为-1价 | |
| B. | Fe2O3为氧化产物,SO2是还原产物 | |
| C. | lmolCuFeS2反应转移电子为13mol | |
| D. | 该反应的所有产物均既是氧化产物,又是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,12g石墨中含有2NA个C-C键 | |
| B. | 室温下,22.4L正戊烷中含有16NA个σ键 | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为4NA | |
| D. | 62g P4分子中含有2NA个P-P键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
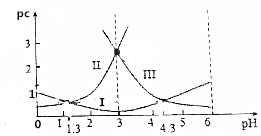 草酸(H2C2O4)水溶液中pc(H2C2O4)、pc(HC2O4-)、pc(C2O42-)随着溶液pH的变化曲线如图所示,下列说法中不正确的是( )
草酸(H2C2O4)水溶液中pc(H2C2O4)、pc(HC2O4-)、pc(C2O42-)随着溶液pH的变化曲线如图所示,下列说法中不正确的是( )| A. | pH=4时,c(HC2O4-)>c(C2O42-) | |
| B. | c(H2C2O4)+c(HC2O4-)+c(C2O42-)一定不变 | |
| C. | 草酸的电离常数Ka1=10-1.3 | |
| D. | $\frac{c({C}_{2}{{O}_{4}}^{2-})•c({H}_{2}{C}_{2}{O}_{4})}{{c}^{2}(H{C}_{2}{{O}_{4}}^{-})}$=10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,在VmL0.01mol•L-1的BOH溶液中滴加0.01mol•L-1盐酸,溶液pH与盐酸体积之间的关系如图所示.下列推断不正确的是( )
常温下,在VmL0.01mol•L-1的BOH溶液中滴加0.01mol•L-1盐酸,溶液pH与盐酸体积之间的关系如图所示.下列推断不正确的是( )| A. | BOH电离方程式为BOH═B++OH- | |
| B. | 该盐酸溶液的pH=2 | |
| C. | 点c表示的溶液中c(OH-)=1.0×10-6mol•L-1 | |
| D. | BOH(aq)+HCl(aq)═BCl(aq)+H2O(l)△H<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com