
| A.在离子化合物里,只存在离子键,没有共价键 |
| B.非极性键只存在于双原子的单质分子中 |
| C.共价化合物中只有共价键,一定没有离子键 |
| D.由不同元素组成的含多个原子的分子里,一定只存在极性键 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.配合物中中心原子的电荷数和配位数均为6 |
| B.该配合物可能是平面正方形结构 |
| C.Cl-和NH3分子均与Pt4+配位 |
| D.配合物中Cl-与Pt4+配位,而NH3分子与Pt4+不配位 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 O2[PtF6],O2[PtF6]为配位化合物(其中Pt为+5价),对于此反应,下列说法正确的是
O2[PtF6],O2[PtF6]为配位化合物(其中Pt为+5价),对于此反应,下列说法正确的是| A.O2[PtF6]的配位原子是F和O,配位数为8 |
| B.此反应O2是氧化剂,PtF6是还原剂 |
| C.O2[PtF6]中Pt与F之间以离子键相结合 |
| D.每生成1mol O2[PtF6],转移1 mol电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.胶体区别于其他分散系的本质特征是分散质微粒直径在1 nm~100 nm之间 |
| B.NH3的沸点高于PH3,是因为N-H键能大于P-H键能 |
| C.金属阳离子只存在于离子晶体中 |
| D.由非金属元素组成的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 分子或离子 | 孤对电子对数 | VSEPR模型名称 | 中心原子杂化轨道类型 | 分子或离子的立体构型名称 |
| CH4 | 0 | 正四面体形 | sp3 | 正四面体形 |
| BeCl2 | | | | |
| SO2 | | | | |
| CH3+ | | | | |
| SO42- | | | | |
| NCl3 | | | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
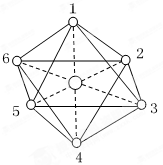
| A.2 种 | B.3 种 | C.4 种 | D.5种 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | X | Y | Z |
| I1 | 496 | 738 | 577 |
| I2 | 4562 | 1451 | 1817 |
| I3 | 6912 | 7733 | 2754 |
| | 9540 | 10540 | 11578 |
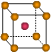
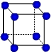
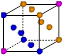
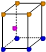

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
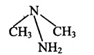
| A.分子式为C2H8N2,结构简式为CH3—NH—NH—CH3 |
B.分子中所有的化学键都是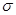 键 键 |
| C.分子中碳、氮两种原子与周边原子所形成的构型均为三角锥型 |
| D.在氧气中完全燃烧生成CO2、N2和H2O,则分子中碳、氮和氢三种元素均被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com