
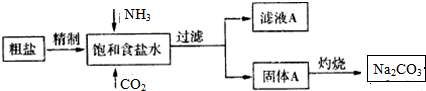
分析 (1)据根据SO42-、Ca 2+、Mg2+等易转化为沉淀而被除去,以及根据不能产生新杂质的要求排序,前面加入的过量溶液应用后加入的溶液除去,最后加入适量的溶液;NH3易溶于水,有利于吸收溶解度不大的CO2;
(2)根据固体在坩埚加热分解;
根据NH4+的检验方法:取少量滤液A于试管中,加入足量NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝色的气体,证明A中含有NH4+;NH4+和HCO3-都能与氢氧根离子反应;
(3)灼烧是将碳酸氢钠分解成碳酸钠;根据碳酸氢钠受热分解前后的固体质量变化可求得碳酸氢钠的质量,进而计算纯碱中碳酸氢钠的质量分数.
解答 解:(1)①SO42-、Ca2+、Mg2+等分别与Ba(OH)2溶液、Na2CO3溶液、Ba(OH)2溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的Ba(OH)2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加Ba(OH)2溶液再加Na2CO3溶液,过滤,最后加入盐酸,
故答案为:c;d;e;
②NH3易溶于水,有利于吸收溶解度不大的CO2,所以向饱和食盐水中先通入NH3,后通人CO2,
故答案为:NH3易溶于水,有利于吸收溶解度不大的CO2;
(2)灼烧固体碳酸氢钠制Na2CO3,在坩埚加热分解,取少量滤液A于试管中,加入足量NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝色的气体,证明A中含有NH4+,NH4+和HCO3-都能与氢氧化钠反应:NH4++HCO3-+2OH-=NH3•H2O+CO32-+H2O;
故答案为:a;取少量滤液A于试管中,加入足量NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝色的气体,证明A中含有NH4+;NH4++HCO3-+2OH-=NH3•H2O+CO32-+H2O;
(3)灼烧是将碳酸氢钠分解成碳酸钠,反应的方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+Na2CO3+H2O,加热前固体质量为a g,充分加热后质量变为b g,固体的质量差为(a-b)g,
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+Na2CO3+H2O△m
2×84 106 62
m (a-b)g
m=$\frac{84(a-b)}{31}$g,
所以纯碱中碳酸氢钠的质量分数ω(NaHCO3)=$\frac{\frac{84(a-b)}{31}}{a}$=$\frac{84(a-b)}{31a}$,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+Na2CO3+H2O;$\frac{84(a-b)}{31a}$.
点评 本题以制碱原理制取Na2CO3,涉及到物质的除杂和提纯,常见的实验操作,物质的制备等,难度中等,培养了学生运用知识的能力.


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:解答题

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
 、SO2、CO2及水蒸气,混合气体通过试剂的顺序是
、SO2、CO2及水蒸气,混合气体通过试剂的顺序是
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 CH3COOCH2CH3+H2O,用饱和的碳酸钠溶液(填药品名称)收集粗产品,用分液(填操作名称)的方法把粗产品分离.
CH3COOCH2CH3+H2O,用饱和的碳酸钠溶液(填药品名称)收集粗产品,用分液(填操作名称)的方法把粗产品分离.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是甲、乙两种物质的溶解度曲线.在t2℃时向盛有100g水的烧杯中先后加入wg甲和wg乙(两种物质溶解时互不影响),充分搅拌.将混合物的温度降低到t1℃.下列说法正确的是( )
如图是甲、乙两种物质的溶解度曲线.在t2℃时向盛有100g水的烧杯中先后加入wg甲和wg乙(两种物质溶解时互不影响),充分搅拌.将混合物的温度降低到t1℃.下列说法正确的是( )| A. | 甲物质的溶解度随温度升高而减小 | |
| B. | 温度降低到t1℃时,得到甲、乙的饱和溶液 | |
| C. | 温度降低到t1℃时,甲、乙的溶质质量分数相等,得到甲、乙的不饱和溶液 | |
| D. | t2℃时,甲物质的溶液为饱和溶液,乙物质的溶液为不饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯能使酸性高锰酸钾溶液褪色 | |
| B. | 甲苯与浓硫酸和浓硝酸混酸反应生成2,4,6-三硝基甲苯 | |
| C. | 1mol甲苯能与3mol氢气发生加成反应 | |
| D. | 甲苯可以燃烧并产生浓烈的黑烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | 氯化铁溶液加热蒸干最终得不到氯化铁固体 | |
| ② | 镀锡的铁制品,镀层部分受损后,露出的铁表面更易被腐蚀 | |
| ③ | 电解精炼铜时,每转移2mol电子阳极上溶解的铜原子数为NA | |
| ④ | 在lL0.1mol.L-1碳酸钠溶液中,阴离子总数大于0.1NA |
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{pq}{mt}$mol/(L.S) | B. | $\frac{mt}{pq}$mol/(L.S) | C. | $\frac{mp}{qt}$mol/(L.S) | D. | $\frac{tp}{mq}$mol/(L.S) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com