
| A. | 石灰石与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| B. | 氧化铁和稀硫酸反应:Fe2O3+6H+=2Fe2++3H2O | |
| C. | 氢氧化铜溶于盐酸:Cu2++2OH-+2H+=Cu2++2H2O | |
| D. | 铁屑溶于稀硫酸溶液:2Fe+6H+=2Fe3++3H2↑ |
分析 A.反应生成氯化钙、水、二氧化碳;
B.反应生成硫酸铁、水;
C.氢氧化铜在离子反应中保留化学式;
D.反应生成硫酸亚铁和氢气.
解答 解:A.石灰石与盐酸反应的离子反应为CaCO3+2H+=Ca2++CO2↑+H2O,故A正确;
B.氧化铁和稀硫酸反应的离子反应为Fe2O3+6H+=2Fe3++3H2O,故B错误;
C.氢氧化铜溶于盐酸的离子反应为Cu(OH)2+2H+=Cu2++2H2O,故C错误;
D.铁屑溶于稀硫酸溶液的离子反应为Fe+2H+=Fe2++H2↑,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电荷守恒,题目难度不大.


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L氮气所含的原子数为NA | |
| B. | 1mol硫与铁充分反应转移的电子数为2NA | |
| C. | 常温常压下,48gSO3含有的分子数为3NA | |
| D. | 常温常压下,1molNO2气体与水反应生成NA个NO3-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
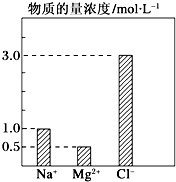 根据要求回答下列有关问题:
根据要求回答下列有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
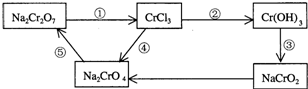
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可回收垃圾如纸类、金属、塑料、玻璃等,通过综合处理、回收利用,不仅可以减少污染,而且还可以节省资源 | |
| B. | 有害垃圾如废电池、废日光灯管、废水银温度计、过期药品等,这些垃圾需要进行特殊安全处理 | |
| C. | 厨余垃圾如剩菜剩饭、骨头、菜根菜叶等食品类废物,经生物技术就地处理堆肥,可以作为有机肥料,直接被农作物吸收和利用 | |
| D. | “白色污染”主要指的是我们日常用的塑料袋,它污染土壤的主要原因是不易被分解,影响正常的物质循环 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mol氧约含有6.02×1024个氧分子 | |
| B. | NA 约等于6.02×1023 | |
| C. | 摩尔是国际科学界广泛使用的一种物理量 | |
| D. | 摩尔是物质的量的单位,简称摩,符号为mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
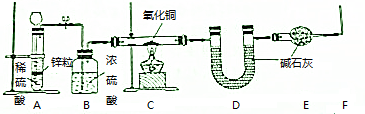
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com