
向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸,下列离子方程式与事实不符的是( )
|
| A. | OH﹣+CO32﹣+2H+→HCO3﹣+H2O | B. | 2OH﹣+CO32﹣+3H+→HCO3﹣+2H2O |
|
| C. | 2OH﹣+CO32﹣+4H+→CO2↑+3H2O | D. | OH﹣+CO32﹣+3H+→CO2↑+2H2O |
| 真题集萃;离子方程式的书写. | |
| 专题: | 离子反应专题. |
| 分析: | 等物质的量浓度的NaOH和Na2CO3的混合溶液中含有氢氧化钠与碳酸钠的物质的量相等,稀盐酸加入到NaOH和Na2CO3的混合溶液中,盐酸先与氢氧化钠发生酸碱中和,剩余的盐酸再与碳酸钠发生反应,盐酸少量时发生CO32﹣+H+→HCO3﹣,盐酸过量时发生CO32﹣+2H+→CO2↑+H2O. |
| 解答: | 解:根据题意可知,等物质的量浓度的NaOH和Na2CO3的混合溶液中,含有的氢氧化钠与碳酸钠的物质的量相等,稀盐酸加入到NaOH和Na2CO3的混合溶液中,盐酸先与氢氧化钠发生酸碱中和,剩余的盐酸再与碳酸钠发生反应. A.设NaOH和Na2CO3的物质的量都为1mol,则加入盐酸少量,先发生反应:OH﹣+H+→H2O,1mol氢氧化钠消耗1mol盐酸,再发生反应CO32﹣+H+→HCO3﹣,将两个方程式相加得:OH﹣+CO32﹣+2H+→HCO3﹣+H2O,故A正确; B.设NaOH和Na2CO3的物质的量都为2mol,则加入盐酸少量,先发生反应:2OH﹣+2H+→2H2O,2mol氢氧化钠消耗2mol盐酸,再发生反应CO32﹣+H+→HCO3﹣,盐酸不足之消耗1mol碳酸钠,将两个方程式相加得:2OH﹣+CO32﹣+3H+→HCO3﹣+2H2O,故B正确; C.设NaOH和Na2CO3的物质的量都为2mol,2mol氢氧化钠消耗2mol氢离子,剩余2mol氢离子与2mol碳酸钠反应生成2mol碳酸氢根离子,离子方程式应为2OH﹣+2CO32﹣+4H+→2HCO3﹣+2H2O,即OH﹣+CO32﹣+2H+→HCO3﹣+H2O,故C错误; D.设NaOH和Na2CO3的物质的量都为1mol,则加入盐酸过量,先发生反应:OH﹣+H+→H2O,1mol氢氧化钠消耗1mol盐酸,再发生反应CO32﹣+2H+→CO2↑+H2O,将两个方程式相加得:OH﹣+CO32﹣+3H+→CO2↑+2H2O,故D正确; 故选:C. |
| 点评: | 本题考查了离子方程式书写正误的判断,题目难度中等,明确稀盐酸与NaOH和Na2CO3反应的先后顺序以及碳酸钠与盐酸反应的原理是解题的关键. |


科目:高中化学 来源: 题型:
甲、乙、丙三种有机物的结构简式如下图所示,下列说法不正确的
是
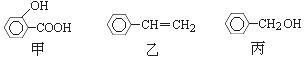
A.甲、乙、丙都能发生加成反应、取代反应
B.丙与C6H5OH都含有-OH,质谱图显示的质荷比最大值相差14,但不属于同系物
C.淀粉、油脂、有机玻璃等都属于高分子化合物
D.乙的化学名称为苯乙烯,能使溴水褪色,但不存在顺反异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
欲除去下列物质中的杂质(括号内为杂质)所用试剂和操作方法都正确的是
①Cl2(HCl):饱和食盐水、过滤 ②CO2(SO2):饱和Na2CO3溶液、洗气
③铁粉(铝粉):NaOH、过滤 ④MnO2(KCl):水、溶解后过滤
⑤碳粉(碘单质):CCl4、分液
A.①②③ B.②④⑤ C.③④ D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
|
| A. | 足量的CO2通入饱和碳酸钠溶液中:CO2+CO32﹣+H2O→2HCO3﹣ |
|
| B. | FeSO4溶液在空气中变质:4Fe2++O2+2H2O→4Fe3++4OH﹣ |
|
| C. | 向NaAlO2溶液中通入过量CO2:2AlO2﹣+CO2+3H2O→2Al(OH)3↓+CO32﹣ |
|
| D. | 碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3﹣+2Ca2++4OH﹣→2CaCO3↓+Mg(OH)2↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
对于复分解反应:X+Y→Z+W,下列叙述正确的是( )
|
| A. | 若Z是强酸,则X和Y必有一种是强酸 |
|
| B. | 若X是强酸,Y是盐,反应后可能有强酸或弱酸生成 |
|
| C. | 若Y是强碱,X是盐,则Z或W必有一种是弱碱 |
|
| D. | 若W是弱碱,Z是盐,则X和Y必有一种是强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如图所示.
请回答下列问题:
(1)X的单质与A反应的化学方程式是 .
(2)若试剂1是NaOH溶液,X的单质与试剂1反应的离子方程式是 .
(3)若试剂1和试剂2均是稀硫酸.
①检验物质D的溶液中金属离子的方法是 .
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示) .
③某高效净水剂是由Y(OH)S04聚合得到的.工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
戊二醛(OHCCH2CH2CH2CHO)在pH为7.5~8.5时,杀菌消毒的作用最强,可杀灭细菌的繁殖体和芽孢、真菌、病毒,其作用较甲醛强2~10倍。下列有关说法正确的是
A.戊二醛的消毒原理与漂白粉、臭氧等消毒剂不相同
B.1 mol 戊二醛分子可被1 mol Cu(OH)2完全氧化
C.CH3CH=CHCH2COOH与戊二醛互为同分异构体
D.10g戊二醛完全燃 烧需消耗0.5 mol O2
烧需消耗0.5 mol O2
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学课外活动小组的同学在学习NH3的性质时讨论:既然NH3具有还原性,能否像H2那样还原CuO
呢?于是他们设计了如下实验装置(夹持装置未画出)进行实验。

请回答下列问题:
(1)仪器a的名称为______________;仪器b中可选择的试剂为______________;
(2)实验中观察到装置C中黑色CuO粉末变为红色固体,干燥管D增重,量气管内收集到无色无味的单质气体,上述现象可以证明NH3具有________性,写出相应的化学方程式_____________;
(3)E装置中浓硫酸的作用是________________________________
(4)读取气体体积前,应对装置F进行的操作是:________________________若读数时,量气管中的液面低于水准管的液面,则量气管中气体的体积将_____。(填“偏大”、“偏小”或“不变”)。
(5)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物,在酸性溶液中,Cu+易发生自身的氧化还原反应(2Cu+ →Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O: 。
(6)此套实验装置还可用于测定氨气的分子组成。若实验完毕,测得干燥管D增重m克,装置F测得气体的体积为n升(已折算成标准状况),则氨分子中氮、氢的原子个数比为________(用含m、n字母的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质仅用蒸馏水不能鉴别的是( )
A.苯、酒精、硝基苯 B.食盐、烧碱、硝酸铵
C.蔗糖、硫酸铜粉末、碳酸钙粉末 D.氧化铜、二氧化猛、活性炭
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com