
| A. | 常温下锌与浓硫酸不反应,与稀硫酸反应生成氢气 | |
| B. | 加入过量氨水,有白色沉淀生成,则原溶液一定有Al3+ | |
| C. | 向FeI2溶液中通入少量Cl2,再滴加少量CCl4,振荡、静置,下层液体为紫色 | |
| D. | FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体剩余,加入KCSN溶液变成血红色 |
分析 A.浓硫酸具有强的氧化性,常温下能够与锌反应;
B.能够与氨水反应产生沉淀的可以是铝离子或者是镁离子;
C.氯气氧化性强于碘离子,能氧化碘离子生成单质碘,单质碘易溶于四氯化碳;
D.金属铁、铜都可以和铁离子之间发生反应;
解答 解:A.浓硫酸具有强的氧化性,常温下能够与锌反应生成硫酸锌、二氧化硫和水,故A错误;
B.加入过量氨水,有白色沉淀生成,则原溶液可能有Al3+,也可能含有Mg2+,故B错误;
C.氯气氧化性强于碘离子,能氧化碘离子生成单质碘,单质碘易溶于四氯化碳,四氯化碳密度大于水,萃取后碘的四氯化碳层在下层,故C正确;
D.FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体剩余,则溶液中一定不含有铁离子,加入KCSN溶液不会变成血红色,故D错误;
故选:C.
点评 本题考查了元素化合物知识,熟悉浓硫酸、铁、锌、铝的性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题

| 10℃ | 20℃ | 40℃ | 60℃ | 80℃ | |
| Ba(OH)2•8H2O | 2.48 | 3.89 | 8.22 | 20.9 | 101 |
| NaOH | 98.0 | 109 | 129 | 174 | 314 |
| NaCl | 35.8 | 35.9 | 36.4 | 37.1 | 38.0 |
| BaCl2 | 33.5 | 35.8 | 40.8 | 46.2 | 52.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g H2O含有10NA个质子 | |
| B. | 1 mol/LCH3COONa溶液中含有1 mol/LCH3COO- | |
| C. | 标准状况下,22.4 L氨水含有NA个NH3分子 | |
| D. | 56 g铁片投入足量浓H2SO4中生成NA个SO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红热的铁与水蒸气反应可生成氧化铁和氢气 | |
| B. | 将二氧化硫通入到紫色石蕊溶液中,溶液先变红后褪色 | |
| C. | 加热时,可将试管、蒸发皿、坩埚直接在酒精灯焰上加热 | |
| D. | 称量氢氧化钠固体时,应将氢氧化钠固体放在称量纸上称量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
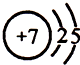 .
.| Al(OH)3 | Ga(OH)3 | |
| 酸式电离常数Ka | 2×10-11 | 1×10-7 |
| 碱式电离常数Kb | 1.3×10-33 | 1.4×10-34 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCO2与SO3的混合气体氧原子数为2NA | |
| B. | 1mol/L KClO3溶液中含有NA个ClO3- | |
| C. | 标准状况下,11.2LCCl4所含的分子数为0.5NA | |
| D. | 25℃,1.01×105Pa,88gCO2中所含原子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,F元素离子基态时的电子排布式1s22s22p63s23p6,E元素的原子结构示意图是
,F元素离子基态时的电子排布式1s22s22p63s23p6,E元素的原子结构示意图是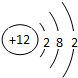 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com