
| A、当酸碱恰好完全中和时,溶液呈中性 |
| B、若溶液中c(H+)与c(OH-)相等,溶液肯定呈中性 |
| C、0.005 mol?L-1 Ba(OH)2溶液中,水电离出的c(OH-)为10-12 mol?L-1 |
| D、NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |


科目:高中化学 来源: 题型:
| A、10 | B、9 |
| C、11.5 | D、12.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
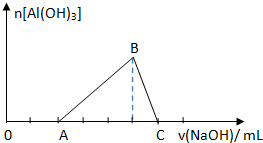 已知25℃时Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38.向Fe(NO3)3和Al(NO3)3的混合溶液中逐滴加入NaOH溶液,生成Al(OH)3沉淀的物质的量与加入NaOH溶液体积的关系如图所示.计算表明当Fe3+完全沉淀时,Al3+恰好开始沉淀.下列说法正确的是( )
已知25℃时Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38.向Fe(NO3)3和Al(NO3)3的混合溶液中逐滴加入NaOH溶液,生成Al(OH)3沉淀的物质的量与加入NaOH溶液体积的关系如图所示.计算表明当Fe3+完全沉淀时,Al3+恰好开始沉淀.下列说法正确的是( )| A、原混合溶液中c(Fe3+):c(Al3+)=1:1 |
| B、B点两种沉淀共存,此时上层清液中c(Fe3+)=c(Al3+)=0 |
| C、B点两种沉淀共存,此时上层溶液中c(Al3+):c(Fe3+)=2.5×104:1 |
| D、C点溶液中的溶质只有NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、等物质的量的NH4HCO3与Ba(OH)2溶液混合后加热:NH4++OH-
| ||||
| B、酸性的淀粉碘化钾溶液在空气中变蓝:4I-+O2+4H+=2H2O+2I2 | ||||
| C、1molCl2通入含1mol FeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | ||||
| D、过量SO2通入Ba(NO3)2溶液中:3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:


 是一种高分子材料,其单体的结构简式是
是一种高分子材料,其单体的结构简式是
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 编号 | 信 息 |
| 1 | D为地壳中含量最高的元素组成的单质 |
| 2 | E为酸性气态氧化物 |
| 3 | F的浓溶液常做干燥剂 |
| 4 | H为淡黄色固体化合物 |
| 5 | 电解饱和J溶液是工业重要反应 |
| 6 | C为离子化合物,阴、阳离子均含有金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 卤族元素的单质和化合物很多,一氯化碘(ICl)、三氯化碘(ICl3),由于它们的性质与卤素相似,因此被称为卤素互化物.请利用所学物质结构与性质的相关知识回答下列问题:
卤族元素的单质和化合物很多,一氯化碘(ICl)、三氯化碘(ICl3),由于它们的性质与卤素相似,因此被称为卤素互化物.请利用所学物质结构与性质的相关知识回答下列问题: 和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6
和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com