
【题目】高铁酸钾(K2FeO 4)是一种新型、高效、多功能水处理剂,下列反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6□+8H2O。下列说法不正确的是
A. 每转移1mole-,可以得到33g K2FeO4
B. □处的物质应为KCl
C. 该反应中铁元素的化合价升高
D. 氧化性:Cl2>K2FeO4
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】为使空气质量达标,完成二氧化硫、氮氧化物排放量下降的目标,离不开各种化学处理方法。
(1)一定条件下,用CO处理燃煤烟气中的SO2可生成液态硫,实现硫的回收。
己知:2CO(g)+O2(g)![]() 2CO2(g)△H=-566kJ·mol-1
2CO2(g)△H=-566kJ·mol-1
S(l)+O2(g)![]() SO2(g)△H=-296kJ·mol-1
SO2(g)△H=-296kJ·mol-1
则用CO处理燃煤烟气中SO2的热化学方程式是__________________________________,该反应的平衡常数表达式为K=_________________________。
(2)研究发现利用反应4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)可消除NO的污染。当NH3与NO的物质的量之比分别为1∶3、3∶1和4∶1时;NO脱除率随温度变化的曲线如图所示,则:
4N2(g)+6H2O(g)可消除NO的污染。当NH3与NO的物质的量之比分别为1∶3、3∶1和4∶1时;NO脱除率随温度变化的曲线如图所示,则:
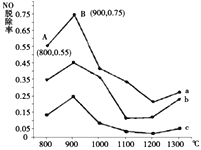
①一定温度下密闭的恒压容器中,能表示上述反应达到化学平衡状态的是___________(填字母)。
a.4v逆(N2)=v正(O2)
b.混合气体的密度保持不变
c.c(N2)∶c(H2O)∶c(NH3)=4∶6∶4
d.单位时间内断裂12molN-H键的同时断裂4molN≡N键
②曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_______mg/(m3·s)。
③曲线b对应的NH3与NO的物质的量之比是___________,做出该判断的理由是___________。
(3)采用NaClO2溶液作为吸收剂可同时进行脱硫、脱硝的处理。已知,温度为323K时,在浓度为5×10-3mol·L-1的NaClO2溶液中通入含有SO2和NO的混合气,反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
c/(mol·L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
则NaClO2溶液脱硝过程中主要反应的离子方程式为_______________________________;增大压强,NO的转化率__________(填“提高”、“不变"或“降低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钻(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如图(废料中含有Al、Li、Co2O3和Fe2O3等物质)。
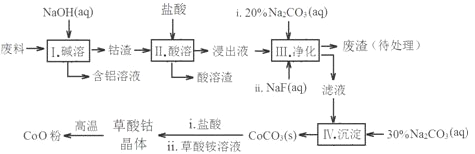
已知:LiF难溶于水,Li2CO3微溶于水。
请回答:
(1)写出I中发生反应的化学方程式并用单线桥标记电子转移的方向和数目________。
(2)写出步骤中Co2O3与盐酸反应生成Cl2的离子方程式_______________。
(3)步骤II所得废渣的主要成分除了LiF外,还有________________。
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤IV所起的作用是___________。
(5)在空气中加热10.98g草酸钴晶体(CoC2O42H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。己知:M(CoC2O42H2O)=183g/mol。
温度范围/℃ | 固体质量/g |
150--210 | 8.82 |
290--320 | 4.82 |
890--920 | 4.5 |
经测定,加热到210℃时,固体物质的化学式为_____。加热到210--290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是_________。温度高于890℃时,固体产物发生分解反应,固体产物为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解精炼铜的阳极泥主要成分为Cu2Te、Ag2Se,工业上从其中回收硒(Se)、碲(Te)的一种工艺流程如下:
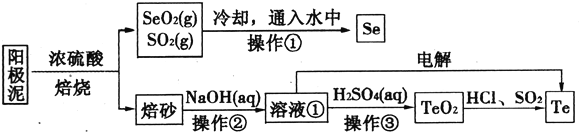
已知:I.TeO2是两性氧化物、微溶于水;
Ⅱ.元素碲在溶液中主要以Te4+、TeO32-、HTeO3-等形式存在;
Ⅲ.25℃时,亚碲酸(H2TeO3)的Ka1=1×10-3,Ka2=2×10-8。
(1)NaHTeO3的溶液的pH____7(填“>”、“=”或“<”)。
(2)SeO2与SO2通入水中反应的化学方程式为________。操作①的名称为__________。
(3)焙砂中碲以TeO2形式存在。溶液①中的溶质主要成分为NaOH、_______。工业上通过电解溶液①也可得到单质碲。已知电极均为石墨,则阴极的电极反应式为____________。
(4)向溶液①中加入硫酸,控制溶液的pH为4.5~5.0,生成TeO2沉淀。如果H2SO4过量,将导致碲的回收率偏低,其原因是________________________。
(5)将纯净的TeO2先溶于盐酸得到四氯化碲溶液,然后将SO2通入到溶液中得到Te单质。由四氯化碲得到Te单质的离子方程式为__________________。
(6)上述流程中可循环利用的物质有__________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,E是具有果香气味的烃的衍生物。A、B、C、D、E在一定条件下存在如下转化关系(部分反应条件、产物被省略)。
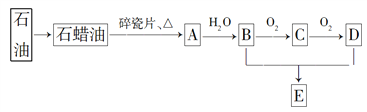
(已知乙醛在一定条件下可被氧化生成乙酸)
(1)丁烷是由石蜡油获得A的过程中的中间产物之一,它的一种同分异构体中含有三个甲基,则这种同分异构体的结构简式为________。
(2)B、D分子中官能团的名称分别是________、________,A→B的反应类型是________。
(3)写出反应A→B 、B→C的化学方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CO、H2和O2组成的混和气体60mL,在一定条件下恰好完全反应,测得生成物在101kPa120℃下对氢气的相对密度为18.75,则原混和气体中H2所占的体积分数为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示装置可以模拟铁的电化学腐蚀。下列说法中,正确的是

A. 若X为碳棒,开关K置于M处可以减缓铁的腐蚀
B. 若X为铜棒,开关K置于N处可以加快铁的腐蚀
C. 若X为碳棒,开关K置于M处,则为牺牲阳极的阴极保护法
D. 若X为碳棒,开关K置于N处,则为外加电流的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出NaHSO4在水中的电离方程式_____。
(2)粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,要除去这些杂质,可选用以下试剂:①Na2CO3、②NaOH、③BaCl2,则试剂加入的先后顺序是_____(填序号)。
(3)实验证明铜不能在低温下与O2反应,也不能与稀H2SO4共热发生反应,但工业上却是将废铜屑倒入热的稀H2SO4中并通入空气来制备CuSO4溶液的,则铜屑在此状态下被溶解的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】40℃时,在氨-水体系中不断通入CO2,各种离子变化趋势如图所示。下列说法不正确的是
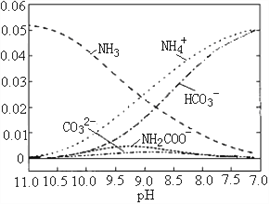
A. 当8.5<pH<10.5时,会有中间产物(NH2COOˉ)生成
B. 在pH=9.5时,溶液中存在关系:c(NH4+)>c(HCO3ˉ)>c(NH2COOˉ)>c(CO32ˉ)
C. 在pH=9.0时,溶液中存在关系:c(NH4+)+c(H+)=2c(CO32ˉ)+c(HCO3ˉ)+c(NH2COOˉ)+c(OHˉ)
D. 随着CO2的通入,![]() 不断减小
不断减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com