
分析 根据溶液的酸碱性以及利用盐类的水解程度来确定溶液中pH大小,酸的酸性越弱则酸的酸根离子水解程度越大,则相同浓度的钠盐溶液其pH越大.
解答 解:①醋酸钠是强碱弱酸盐,醋酸根离子水解而使其溶液呈碱性;
②硫酸氢钠是强酸酸式盐,在水溶液里完全电离而使其溶液呈强酸性;
③氯化钠是强酸强碱盐,钠离子和氯离子都不水解,则其水溶液呈中性;
④苯酚钠是强碱弱酸盐,苯酚根离子水解而使其溶液呈碱性;
醋酸的酸性大于苯酚,所以苯酚根水解程度大于醋酸根离子,则相同浓度的醋酸钠和苯酚钠溶液,苯酚钠的pH都属于醋酸钠,则这几种溶液中pH从大到小顺序是:苯酚钠>醋酸钠>氯化钠>硫酸氢钠,
故答案为:④①③②.
点评 本题考查了pH的大小比较,明确盐的类型及盐类水解程度是解本题关键,硫酸氢钠在水溶液里电离出钠离子、氢离子和硫酸根离子,硫酸氢钠在熔融状态下电离出钠离子和硫酸氢根离子,注意硫酸氢钠在水溶液里或熔融状态下电离的不同,为易错点,题目难度不大.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:选择题
| A. | 用纯铜作阳极、粗铜作阴极 | |
| B. | 电解液的成分保持不变 | |
| C. | 屯解过程中,阳极质量的减少与阴明极质量的增加相等 | |
| D. | 阴极电极反应为:Cu2++2e-=Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,12g石墨中含有2NA个C-C键 | |
| B. | 室温下,22.4L正戊烷中含有16NA个σ键 | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为4NA | |
| D. | 62g P4分子中含有2NA个P-P键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
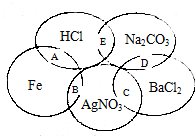 如图为一五元环图案,小明在图案上依次写了五种物质,图中相交的两种物质均可发生化学反应,A、B、C、D、E表示其相应的化学反应.请回答下列问题:
如图为一五元环图案,小明在图案上依次写了五种物质,图中相交的两种物质均可发生化学反应,A、B、C、D、E表示其相应的化学反应.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
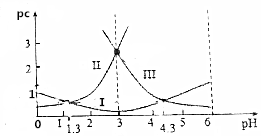 草酸(H2C2O4)水溶液中pc(H2C2O4)、pc(HC2O4-)、pc(C2O42-)随着溶液pH的变化曲线如图所示,下列说法中不正确的是( )
草酸(H2C2O4)水溶液中pc(H2C2O4)、pc(HC2O4-)、pc(C2O42-)随着溶液pH的变化曲线如图所示,下列说法中不正确的是( )| A. | pH=4时,c(HC2O4-)>c(C2O42-) | |
| B. | c(H2C2O4)+c(HC2O4-)+c(C2O42-)一定不变 | |
| C. | 草酸的电离常数Ka1=10-1.3 | |
| D. | $\frac{c({C}_{2}{{O}_{4}}^{2-})•c({H}_{2}{C}_{2}{O}_{4})}{{c}^{2}(H{C}_{2}{{O}_{4}}^{-})}$=10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)>c(SO42-)>c(H+)>c(OH-) | B. | c(NH4+)=2c(SO42-) | ||
| C. | c(NH4+)+c(NH3•H2O)=2c(SO42-) | D. | c(NH4+)+c(H+)=c(OH-)+2c(SO42-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com