
分析 (1)利用n=cV,根据反应前HCl的物质的量减去反应后溶液中HCl的物质的量来计算;
(2)根据金属的质量之和为1.1g及反应中消耗的HCl来列式计算即可.
解答 解:(1)反应中消耗HCl的物质的量为:0.2 L×5mol•L-1-0.2 L×4.6 mol•L-1=0.08mol,
答:反应中消耗HCl的物质的量为0.08mol;
(2)设Al、Fe的物质的量分别为x、y
由2Al+6HCl═2AlCl3+3H2↑、Fe+2HCl═FeCl2+H2↑
则Al~3HCl Fe~2HCl
x 3x y 2y
$\left\{\begin{array}{l}{27x+56y=1.1}\\{3x+2y=0.08}\end{array}\right.$,
解得:x=0.02mol、y=0.01mol,
答:该混合物中铝、铁的物质的量分别为0.02mol、0.01mol.
点评 本题考查混合物反应的计算,题目难度中等,明确金属与酸反应的化学方程式是解答的关键,并学会利用质量关系、消耗的酸来列式计算即可解答,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8 g | B. | 6.5 g | C. | 3 g | D. | 10 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 43.2 g | B. | 46.8 g | C. | 53.6 g | D. | 63.8 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径10-9m~10-7 m | |
| B. | 胶体在生物界普遍存在,应用也很广泛 | |
| C. | 用平行光照射氢氧化铁胶体产生一条光路,是由于光照使之发生分解生成氧化铁 | |
| D. | 氢氧化铁胶体净水是利用了胶体的吸附性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
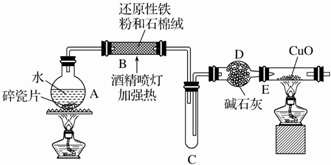
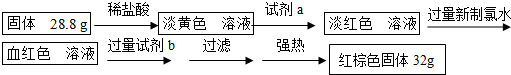
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上利用电解饱和食盐水的产物制盐酸 | |
| B. | 工业上制备漂白粉 | |
| C. | 实验室制取氯气 | |
| D. | 炼铁工业上用石灰石除杂造渣 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com