
| A. | 完全氧化56gFe需要消耗氯气33.6 L | |
| B. | 某浓度氢氧化钠溶液恰好溶解5.4g的铝,则被还原的水的分子数为0.6NA | |
| C. | 向100mL 1mol/L的NaHSO3溶液中加入足量的硫酸铁,则反应后氢离子增加0.4mol | |
| D. | 利用铝热反应将磁铁矿还原得到16.8g铁单质,反应中Fe得到了0.9 NA电子 |
分析 A、氯气所处的状态不明确;
B、求出铝的物质的量,然后根据铝和氢氧化钠溶液反应时,做氧化剂的为水分子来分析;
C、NaHSO3溶液中加入足量的硫酸铁,发生的反应为:HSO3-+2Fe2++H2O=2Fe3++SO42-+3H+;
D、根据铁的质量计算出物质的量,再计算出转移的电子数.
解答 解:A、氯气所处的状态不明确,故消耗的氯气的体积无法计算,故A错误;
B、5.4g铝的物质的量为0.2mol,而铝和氢氧化钠溶液反应时,做氧化剂的为水分子:2Al+2NaOH+6H2O=2NaAlO2+4H2O+3H2↑,且从反应可以看出,当2mol铝参与反应时,做氧化剂的水为6mol,故当0.2mol铝反应时,被还原的水分子为0.6NA,故B正确;
C、NaHSO3溶液中加入足量的硫酸铁,发生的反应为:HSO3-+2Fe2++H2O=2Fe3++SO42-+3H+,由于HSO3-能微弱电离出氢离子,故当1molHSO3-反应时,增加的氢离子小于3mol,故当0.1molNaHSO3完全反应时,反后增加的氢离子小于0.3mol,故C错误;
D、16.8g铁单质的物质的量为0.3mol,由于铁元素反应前为+$\frac{8}{3}$价,反应后变为0价,故当生成0.3mol铁单质时,铁元素得到0.8NA个电子,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
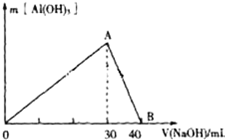 某无色废水中可能含有Fe3+、Al3+、Na+、Cl-、OH-、SO42-、中的几种离子.分别取三份废水进行如下实验:
某无色废水中可能含有Fe3+、Al3+、Na+、Cl-、OH-、SO42-、中的几种离子.分别取三份废水进行如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
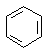 、④HCHO等,其中碳原子不是采取sp2杂化的分子有②(填物质编号),HCHO分子的立体构型为平面三角形.
、④HCHO等,其中碳原子不是采取sp2杂化的分子有②(填物质编号),HCHO分子的立体构型为平面三角形.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
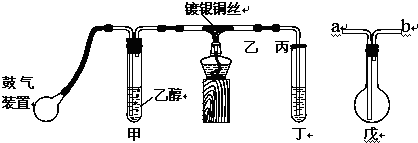
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)我国西周年代写成的算卦占卜的书《周易》中,在谈到一些自然界发生的现象时说:“象曰:‘泽中有火’”试用化学方程式表示出泽中有火的化学反应CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O.西气东输是我国油气管道建设史上距离最长的输气管道,总长3900公里,设计年输气量120亿立方米.这里说的气就是天然气,天然气的主要成分是甲烷(填名称),试分析使用天然气的优点清洁无污染.
(1)我国西周年代写成的算卦占卜的书《周易》中,在谈到一些自然界发生的现象时说:“象曰:‘泽中有火’”试用化学方程式表示出泽中有火的化学反应CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O.西气东输是我国油气管道建设史上距离最长的输气管道,总长3900公里,设计年输气量120亿立方米.这里说的气就是天然气,天然气的主要成分是甲烷(填名称),试分析使用天然气的优点清洁无污染.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.21 mol | B. | 0.25 mol | C. | 0.3 mol | D. | 0.35 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com