
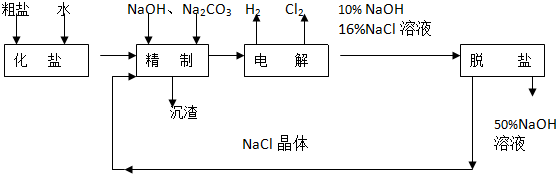
���� ��1����ⱥ��ʳ��ˮ��ԭ������ʽΪ��2NaCl+2H2O$\frac{\underline{\;���\;}}{\;}$2NaOH+H2��+Cl2�������ʳ��ˮ������������Ϊ�������������������Դ��������Ϊ����������������NaOH��
��2���ÿ����Ե�̼���Ƴ�ȥ�����ӣ���NaOH��ȥþ���ӣ�
��3�����ӱ��Լ���ȥSO42-��ע�ⲻ�������µ����ʣ�
��� �⣺��1������Ȼ�����Һʱ��������������ʧ�������������Ĺ��̣��缫��ӦʽΪ2Cl--2e-=Cl2���������������ӵõ������������Ĺ��̣������缫��Ӧ��2H++2e-=H2�����ü����������ӣ��缫������ҺpH���ߣ������������ƣ��ܷ�ӦΪ2NaCl+2H2O$\frac{\underline{\;���\;}}{\;}$2NaOH+H2��+Cl2����
�ʴ�Ϊ��2NaCl+2H2O$\frac{\underline{\;���\;}}{\;}$2NaOH+H2��+Cl2����NaOH��H2��
��2��Ca2+��Mg2+��������̼���ơ�NaOH��Ӧת��Ϊ��������Ӧ����ʽ�ֱ�ΪMgCl2+2NaOH=2NaCl+Mg��OH��2����CaCl2+Na2CO3=CaCO3��+2NaCl��
�ʴ�Ϊ��MgCl2+2NaOH=2NaCl+Mg��OH��2����CaCl2+Na2CO3=CaCO3��+2NaCl��
��3�����������SO42-�����ϸߣ��������ӱ��Լ���ȥSO42-���ñ��Լ�ѡ���ԭ���Dz��������Գ�ȥ���������ӣ�
A��Ba��OH��2����������Լ����������ȫ����������������ͨ������PHֵ��ȥ����A���ϣ�
B��Ba��NO3��2����������Լ�����������Ӳ��ܳ�ȥ�����������������������B�����ϣ�
C��BaCl2����������Լ����������ȫ�������������Ӳ����������ӣ���C���ϣ�
�ʴ�Ϊ��AC��
���� �������ȼҵΪ���忼����������ᴿ���ۺ�Ӧ�ã�Ϊ��Ƶ���㣬���շ��������еķ�Ӧ���������뷽���Լ����ԭ��Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬��Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 10��20mL 3mol/L��X��Һ | B�� | 20��10mL 4mol/L��X��Һ | ||
| C�� | 20��30mL 2mol/L��X��Һ | D�� | 10��10mL 2mol/L��X��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  2-�һ����� 2-�һ����� | B�� | CH3CHBr2�������� | ||
| C�� |  2-����ϩ 2-����ϩ | D�� | 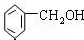 ���״� ���״� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
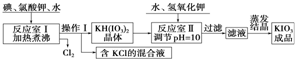
| KCl | KH��IO3��2 | KClO3 | |
| �ܽ��g/100gˮ��25�棩 | 20.8 | 0.8 | 7.5 |
| �ܽ��g/100gˮ��80�棩 | 37.1 | 12.4 | 16.2 |
| �������� | ʵ������ |
| ȡ1g������NaCl����3mLˮ�����Һ�� | ��Һ�ޱ仯 |
| ����5�ε�����Һ��1mL 0.1mol/L KI��Һ���� | ��Һ�ޱ仯 |
| Ȼ���ٵ���1��1mol/L��H2SO4���� | ��Һ����ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �÷�Ӧ�Ļ�ѧ����ʽΪ2H2CrO4+3H2O2=2Cr��OH��3+3O2��+2H2O | |
| B�� | �÷�Ӧ�е���������H2O2����ԭ������O2 | |
| C�� | �����ԣ�H2CrO4��O2 | |
| D�� | �練Ӧת����0.3 rnol���ӣ�������������ڱ�״�������Ϊ3.36 L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CO2��SO2 | B�� | CH4��NH3 | C�� | SO3��BF3 | D�� | H2S��CCl4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 18O 31P 35Cl | B�� | 27Al 19F 12C | ||
| C�� | ��һ��������Ԫ�ص�ԭ�� | D�� | Ԫ�����ڱ��Т�A����Ԫ�ص�ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
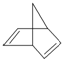 �������ʽΪC7H8��
�������ʽΪC7H8�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
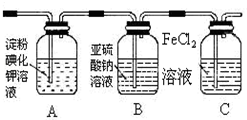
| ʵ�鲽�� | Ԥ������ͽ��� |
����1��ȡ����ϴ��ƿB����Һ���Թ�A�У��μӹ���2mol/LHCl��1mol/LBaCl2��Һ �� | �������İ�ɫ��������ϴ��ƿB��Һ�д���SO42- |
����2����ȡ����ϴ��ƿB����Һ���Թ�B�У��μӵμ������lmol/LBa��NO3��2��Һ �����ã� | ������ɫ������ |
����3��ȡ����2���Թ�B�е��ϲ���Һ���Թ�C�У� �μ�0.1mol/LAgNO3��Һ������2mol/LHNO3������ | ��������ɫ��������ϴ��ƿB��Һ�д��������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com