
(11分)如图装置,A、B中的电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹;电源有a、b两极.若A、B中充满KOH溶液后倒立于KOH溶液的水槽中.切断K1,合闭K2、K3通直流电,回答下列问题:

①判断电源的正、负极:a为________极,b为________极。
②在湿的Na2SO4溶液滤纸条中心的KMnO4液滴,有什么现象 。
③写出电极反应式:A极 ,C极 。
④若电解一段时间后,A、B中均有气体包围电极.此时切断K2、K3,合闭K1,则电流表的指针是否移动(填是或否) 。说明理由____________________________。
(11分)①负、正。(2分) ②紫色向D方向移动,两极有气体产生。(2分)
③4OH――4e=2H2O+O2↑,4H++4e=2H2↑。(4分) ④是;组成氢氧燃料电池。(3分)
【解析】
试题分析:①惰性电极电解氢氧化钾溶液的实质是电解水,阴阳极分别生成氢气和氧气。根据试管B中气体的体积大可知,生成的气体是氢气,即B是阴极,则a是负极,b是正极。
②惰性电极电解硫酸钠的实质也是电解水,阴极生成氢气,阳极生成氧气。电解池中阳极失去电子,所以溶液中的阴离子向阳极移动,则实验现象就是紫色向D方向移动,两极有气体产生。
③A电极是阳极,OH―放电生成氧气,电极反应式是4OH――4e=2H2O+O2↑;C电极是阴极,氢离子放电生成氢气,电极反应式是4H++4e=2H2↑。
④由于A中生成氧气,B中生成氢气。所以此时切断K2、K3,合闭K1,则构成氢氧燃料电池,所以电流表的指针发生移动。
考点:考查电化学的综合应用
点评:原电池的判断关键是正负极的判断,依据是在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应,据此可以进行有关的判断;电解池中电解产物的判断是难点,方法是首先判断阳极电极材料。如果是活性电极,则电极本身失去电子。如果是惰性电极,则溶液中的阴离子失去电子。而阴极是溶液中的阳离子得到电子,所以需要熟练记住常见离子的放电顺序。


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
如图装置,A、B中的电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹;电源有a、b两极。若在A、B充满KOH溶液后倒立于KOH溶液的水槽中。切断K1合闭K2、K3,通直流电,回答下列问题:

(1)判断电源的正、负极:a为 极,b为 极。
(2)在湿的Na2SO4溶液滤纸条中心的KMnO4液滴,有什么现象 。
(3)写出电极反应式:A极是 ,B极是 。
(4)若电解一段时间后,A和B中均有气体包围电极。此时切断K2和K3,闭合K1,则电流表的指针
(填是或否)移动。若电流表指针不移动,说明理由;若指针移动,也说明理由:
。
查看答案和解析>>
科目:高中化学 来源:2013届浙江省临海市白云高级中学高三第三次段考化学试卷(带解析) 题型:填空题
(11分)如图装置,A、B中的电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹;电源有a、b两极.若A、B中充满KOH溶液后倒立于KOH溶液的水槽中.切断K1,合闭K2、K3通直流电,回答下列问题: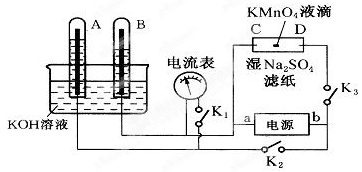
①判断电源的正、负极:a为________极,b为________极。
②在湿的Na2SO4溶液滤纸条中心的KMnO4液滴,有什么现象 。
③写出电极反应式:A极 ,C极 。
④若电解一段时间后,A、B中均有气体包围电极.此时切断K2、K3,合闭K1,则电流表的指针是否移动(填是或否) 。说明理由____________________________。
查看答案和解析>>
科目:高中化学 来源:2009-2010学年吉林一中高一(下)期中化学试卷(奥班)(解析版) 题型:解答题
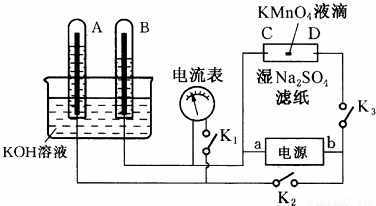
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com