

分析 流程图分析制备反应过程,是氯化铁、氯化亚铁加入水搅拌Ⅰ,加入稳定剂,加入6mol/L的NaOH溶液调节溶液PH=6,生成四氧化三铁、水、氯化钠,搅拌Ⅱ得到黑色糊状物,水洗后烘干得到纳米级Fe3O4,
(1)流程图分析制备反应过程,是氯化铁、氯化亚铁在氢氧化钠溶液中生成四氧化三铁、水、氯化钠;根据电荷守恒可写出该方程式;
(2)反应条件温度低于100°C,需要用水浴加热,水浴加热温度容易控制,加热均匀;
(3)分离固体和液体通常用过滤操作;
(4)Fe3O4达到纳米级,即在溶液形成胶体,利用胶体的丁达尔效应证明Fe3O4达到纳米级;
解答 解:(1)由流程可知,生成Fe3O4的反应物为Fe2+、Fe3+和OH-,根据电荷守恒可写出该方程式为:Fe2++2Fe3++8OH-=Fe3O4+4H2O,
故答案为:Fe2++2Fe3++8OH-=Fe3O4+4H2O;
(2)低于100℃的温度控制通常用水浴加热法,故选B,
故答案为:B;
(3)分离固体和液体通常用过滤操作,从黑色糊状物的悬浊液中分离出Fe3O4的实验操作是过滤;
故答案为:过滤;
(4)Fe3O4达到纳米级,即在溶液形成胶体,利用胶体的丁达尔效应证明Fe3O4达到纳米级,即做丁达尔效应实验(用一支激光笔照射所得产物,如有一条光亮的通路,证明已达纳米级),
故答案为:做丁达尔效应实验(用一支激光笔照射所得产物,如有一条光亮的通路,证明已达纳米级).
点评 本题考查了制备实验的设计,流程分析判断,反应条件的应用,实验基本操作的迁移应用能力,解答此类题的关键是一定要注意题中所给的信息,题目难度中等.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 夜里的月色本身就很美 | |
| B. | 空气中的小水滴颗粒直径约为1nm-100nm | |
| C. | 光线是一种胶体 | |
| D. | 雾是一种胶体,能产生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
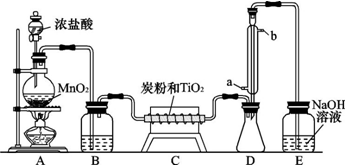
查看答案和解析>>
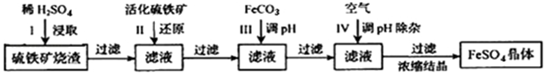
科目:高中化学 来源: 题型:解答题
| 温度/K CO2转化率% $\frac{n({H}_{2})}{n(C{O}_{2})}$ | 500 | 600 | 700 | 800 |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
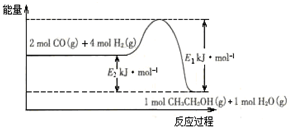
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
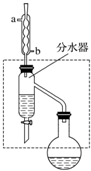 乙酸丁酯是重要的化工原料,具有水果香味.实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:
乙酸丁酯是重要的化工原料,具有水果香味.实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:| 乙酸 | 正丁醇 | 乙酸丁酯 | |
| 熔点/℃ | 16.6 | -89.5 | -73.5 |
| 沸点/℃ | 117.9 | 117 | 126.0 |
| 密度/g•cm-3 | 1.1 | 0.80 | 0.88 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 v(NH3)=5v(O2) | B. | 5v(O2)=6v(H2O) | C. | 4v(NH3)=6 v(H2O) | D. | 4v(O2)=5 v(NO) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com