
苯作萃取剂,并用分液漏斗萃取溴水中的溴单质的实验,下列说法正确的是
A.不能使用酒精作为萃取剂,因为溴单质在酒精中的溶解度比在水中的小
B.静置分层后有色层在下层,水层几乎无色
C.分液漏斗使用前应当用蒸馏水检验是否漏液
D.振荡、静置分层后,依次用两个不同的烧杯从下口分别接取上下两层液体
科目:高中化学 来源:2015-2016学年山西省高一上第一次月考化学试卷(解析版) 题型:选择题
下列实验操作中错误的是
A.蒸发操作时,不能等到混合物中的水分完全蒸干后才停止加热
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,选择的萃取剂的密度必须比水大
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古奋斗中学高二上9月质检化学试卷(解析版) 题型:选择题
有甲、乙、丙、丁四种金属。将甲、乙用导线 相连放入稀H2SO4中可以看到乙慢慢地溶解,而甲的表面有气体逸出。把丁放到乙的硝酸盐溶液中后,丁的表面覆盖一层乙的单质。用石墨电极电解含相同物质的量浓度的甲和丙两种金属的盐溶液,丙的单质先析出。将甲放入稀盐酸中有H2析出。已知四种金属中有一种是铜。根据以上实验判断铜是
A、甲 B、乙 C、丙 D、丁
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三上学期第三次月考化学试卷(解析版) 题型:选择题
有一在空气中暴露过的KOH固体,含水2.8%,K2CO37.2%。取1g该样品 投入25mL 2 mol/L HCl中,中和多余的HCl又用去1.07 mol/L的KOH溶液30.8 ml,蒸发中和后的溶液,所得固体的质量是
投入25mL 2 mol/L HCl中,中和多余的HCl又用去1.07 mol/L的KOH溶液30.8 ml,蒸发中和后的溶液,所得固体的质量是
A.4.50g B.4.00g C.3.73g D.7.45g
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆巴蜀中学高一上10月月考化学试卷(解析版) 题型:选择题
2015年8月12日天津港危险品仓库发生的爆炸事故,再次警示人们在注重提高科技化工发展水平的同时,不可忽视化学试剂存放的基本问题。下列在实验室中关于试剂存放叙述正确的是

A.白磷不易挥发,不需要密闭存放;
B.氢氧化钠溶液应保存在带玻璃塞的细口试剂瓶中
C.氰化物的包装标签上应贴上如图所示的标志
D.用容量瓶配制好溶液进行贮存时,需在容量瓶上贴上浓度标签
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期期中测试化学试卷(解析版) 题型:选择题
下列做法不利于金属防护的是
A.菜刀切菜后不洗净就放回刀架 B.将钢铁制成不锈钢
C.在铁塔的表面喷油漆 D.埋在地下的钢管与锌块连接
查看答案和解析>>
科目:高中化学 来源:2016届湖北省、宜昌一中高三上10月联考化学试卷(解析版) 题型:实验题
(9分)硫代硫酸钠又名“大苏打”,溶液具有弱碱性和较强的还原性,是棉织物漂白后的脱氯剂,定量分析中的还原剂。硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图所示
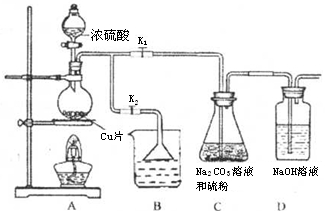
已知:Na2S2O3在酸性溶液中不能稳定存在。
(1)某研究小组设计了制备Na2S2O3·5H2O装置和部分操作步骤如下:
步骤1:如图连接好装置后, ,将D中导管末端浸入水中,微热烧瓶观察气泡和水柱检查装置A、C、D气密性。
步骤2:加入药品,打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸,加热。装置B中的药品可选用下列物质中的。
A.NaOH溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.饱和NaHSO3溶液
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少,当C中溶液的pH 接近7时,打开K2 ,关闭K1即停止C中的反应,停止加热。“当C中溶液的pH接近7时即停止C中的反应”的原因是______________________(用离子方程式表示)。
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液冷却结晶、过滤、洗涤、烘干,得到产品。
(2)Na2S2O3性质的检验:向足量的新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,检查反应后溶液中含有硫酸根,写出该反应的化学方程式_________________。
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL ,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后得混合溶液V mL,将其分成4等份,加入淀粉溶液作指示剂,用0.0010 mol·L-1 的Na2S2O3溶液进行滴定,相关数据记录如下表所示:
编号 | 1 | 2 | 3 | 4 |
消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
部分反应离子方程式为:
①Cr2O72- + 6I- + 14H+ = 2Cr3+ + 3I2 + 7H2O ;②I2 + 2S2O32- = 2I- + S4O64-。
则判断达到滴定终点的现象是__________________。
废水中Ba2+的物质的量浓度为__________________。
查看答案和解析>>
科目:高中化学 来源:2016届重庆市高三上学期第一次月考化学试卷(解析版) 题型:选择题
若NA为阿伏伽德罗常数的值。下列叙述正确的是
A.1.0L1.0mol/L的NaAlO2水溶液中含有的氧原子数为2 NA
B.1mol Na被完全氧化,生成Na2O和Na2O2的混合物时,失去 NA个电子
C.1L 0.1mol/L的FeCl3溶液完全水解后所得胶粒的数目为0.1 NA
D.1mol的羟基与1 mol的氢氧根离子所含电子数均为9NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二10月月考化学试卷(解析版) 题型:选择题
已知H2(g)+I2(g) 2HI(g) ΔH<0,有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
2HI(g) ΔH<0,有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
A.甲、乙提高相同温度 B.甲中加入0.1mol He,乙不改变
C.甲降低温度,乙不变 D.甲增加0.1molH2 ,乙增加0.1mol I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com