
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能/(kJ•mol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
分析 (1)硅原子核外有14个电子,其基态原子的核外电子排布式为1s22s22p63s23p2 ,对应能层分别别为K、L、M,其中能量最高的是最外层M层,该能层有s、p、d三个能级,s能级有1个轨道,p能级有3个轨道,d能级有5个轨道,所以共有9个原子轨道,硅原子的M能层有4个电子(3s23p2);
(2)硅元素在自然界中主要以化合态(二氧化硅和硅酸盐)形式存在;
(3)硅晶体和金刚石晶体类似都属于原子晶体,硅原子之间以共价键结合;利用均摊法计算;
(4)Mg2Si和NH4Cl在液氨介质中反应制得SiH4、NH3和MgCl2;
(5)①烷烃中的C-C键和C-H键大于硅烷中的Si-Si键和Si-H键的键能;
②键能越大、物质就越稳定,C-H键的键能大于C-O键,故C-H键比C-O键稳定,而Si-H键的键能远小于Si-O键,所以Si-H键不稳定而倾向与形成稳定性更强的Si-O键;
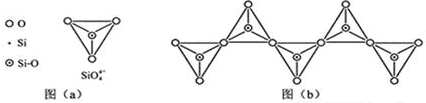
(6)硅酸盐中的硅酸根SiO44-为正四面体结构,所以中心原子Si原子采取了sp3杂化方式;根据图(b)的一个结构单元中含有1个硅、3个氧原子,化学式为SiO32-.
解答 解:(1)硅原子核外有14个电子,其基态原子的核外电子排布式为1s22s22p63s23p2 ,对应能层分别别为K、L、M,其中能量最高的是最外层M层,该能层有s、p、d三个能级,s能级有1个轨道,p能级有3个轨道,d能级有5个轨道,所以共有9个原子轨道,硅原子的M能层有4个电子(3s23p2),
故答案为:M;9;4;
(2)硅元素在自然界中主要以化合态(二氧化硅和硅酸盐)形式存在,
故答案为:二氧化硅;
(3)硅晶体和金刚石晶体类似都属于原子晶体,硅原子之间以共价键结合;硅晶胞中每个顶点上有1个Si、面心是有1个Si、在晶胞内部含有4个Si原子,利用均摊法知,面心提供的硅原子个数=6×$\frac{1}{2}$=3,
故答案为:共价键;3;
(4)Mg2Si和NH4Cl在液氨介质中反应制得SiH4、NH3和MgCl2,方程式为:Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2,
故答案为:Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2;
(5)①烷烃中的C-C键和C-H键大于硅烷中的Si-Si键和Si-H键的键能,所以硅烷中Si-Si键和Si-H键的键能易断裂,导致长链硅烷难以生成,
故答案为:C-C键和C-H键较强,所形成的烷烃稳定,而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成;
②键能越大、物质就越稳定,C-H键的键能大于C-O键,故C-H键比C-O键稳定,而Si-H键的键能远小于Si-O键,所以Si-H键不稳定而倾向与形成稳定性更强的Si-O键,
故答案:C-H键的键能大于C-O键,C-H键比C-O键稳定,而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键;
(6)硅酸盐中的硅酸根SiO44-为正四面体结构,所以中心原子Si原子采取了sp3杂化方式;根据图(b)的一个结构单元中含有1个硅、3个氧原子,化学式为SiO32-,
故答案为:sp3;1:3;SiO32-.
点评 本题主要考查了基态原子的核外电子排布、晶体结构、化学方程式的书写、杂化轨道、化学键等知识,难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷与氯气混合 | B. | 乙烯与氯化氢混合 | ||
| C. | 乙烯与氯气混合 | D. | 乙炔与氯气混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 船体镀锌或锡均可保护船体,镀层破损后将立即失去保护作用 | |
| C. | 由于共价键具有方向性,共价化合物在形成晶体时均采取“紧密堆积” | |
| D. | 反应NH4Cl (s)═NH3(g)+HCl(g)室温下不能自发进行,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com