
(12分)舍勒发现氯气的的方法至今还是实验室制取氯气的主要方法之一.
(1)请写出实验室制氯气的反应化学方程 ,
(2)反应方程式中氧化剂和还原剂物质的量之比为 ;其中Cl2是 产物(填氧化或还原);
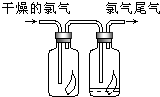
(3)如右图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是 ,从而得出的结论是 .
(4)实验室中剩余的Cl2尾气通常用NaOH溶液吸收,发生反应的离子方程式 。
(12分,每空2分)(1)MnO2 + 4HCl(浓)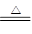 MnCl2 +Cl2↑+ 2H2O;(2)1:2;氧化
MnCl2 +Cl2↑+ 2H2O;(2)1:2;氧化
(3)干燥有色布条不褪色,湿润的有色布条褪条,氯气不具有漂白性,次氯酸具有漂白性。
(4)Cl2 + 2OH-=Cl- + ClO- + H2O
解析试题分析:(1)实验室用二氧化锰和浓盐酸反应制取氯气,所以实验室制氯气的反应化学方程是MnO2 + 4HCl(浓)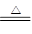 MnCl2 +Cl2↑+ 2H2O。
MnCl2 +Cl2↑+ 2H2O。
(2)根据方程式可知,Mn元素的化合价从+4价降低到+2价,得到2个电子,而氯元素的化合价从-1价升高到0价,失去1个电子,所以氯气是氧化产物,根据电子的得失守恒可知,氧化剂和还原剂的物质的量之比是1:2。
(3)干燥的氯气是没有漂白性的,真正起漂白作用的是次氯酸,所以实验中的现象是干燥有色布条不褪色,湿润的有色布条褪条。因此结论就是氯气不具有漂白性,次氯酸具有漂白性。
(4)氯气有毒需要尾气处理,反应的离子方程式是Cl2 + 2OH-=Cl- + ClO- + H2O。
考点:考查氯气的制备、氯气的性质、尾气处理以及氧化还原反应的有关判断和计算
点评:该题是基础性试题的考查,难度不大。该题的关键是学生要熟练记住氯气的制备原理、氯气的性质,特别是化学性质。另外本题也有利于培养学生的实验安全意识,提高学生的规范操作能力。


科目:高中化学 来源: 题型:
 舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一.
舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一.查看答案和解析>>
科目:高中化学 来源:2015届吉林省长春市高一上学期期末考试化学试卷(解析版) 题型:填空题
(12分)舍勒发现氯气的的方法至今还是实验室制取氯气的主要方法之一.
(1)请写出实验室制氯气的反应化学方程 ,
(2)反应方程式中氧化剂和还原剂物质的量之比为 ;其中Cl2是 产物(填氧化或还原);
(3)如右图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是 ,从而得出的结论是 .
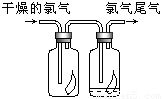
(4)实验室中剩余的Cl2尾气通常用NaOH溶液吸收,发生反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:
舍勒发现氯气的的方法至今还是实验室制取氯气的主要方法之一.
(1)请写出实验室制氯气的反应化学方程 ,
(2)反应方程式中氧化剂和还原剂物质的量之比为 ;其中Cl2是 产物(填氧化或还原);
(3)如右图所示,将氯气依次通过盛有干燥有色布条的广
口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是
,从而得出的结论是 .
(4)实验室中剩余的Cl2尾气通常用NaOH溶液吸收,发生反应的离子方程式 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com