
【题目】8gCH4共有___mol氢原子,0.1molNH3共有约___个原子,同温同压下,同体积的NH3和H2S气体的质量比为___;同温同压下,同质量的NH3和H2S气体的体积比为___。
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】碱性锌锰干电池在放电时,电池的总反应方程式可以表示为: Zn+2MnO2 +2H2O = Zn(OH)2 +2MnOOH。电池放电时,负极上发生反应的物质是
A.Zn B.碳棒 C.MnO2 D.MnO2和H2O
【答案】A
【解析】
试题分析:根据总反应方程式可知Zn在反应中失去电子,发生氧化反应,所以作原电池的负极,MnO2得到电子,发生还原反应,作原电池的正极。因此答案是选项A。
考点:考查根据原电池反应原理确定电池的电极材料的知识
【题型】单选题
【结束】
17
【题目】在恒容隔热容器中,下列说法可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
①1mol N≡N键断裂的同时,有6mol N-H键断裂
②v(H2)=0.9 mol·L-1·min-1,v(NH3)=0.6 mol·L-1·min-1
③保持其他条件不变时,体系气体密度不再改变
④NH3、N2、H2的体积分数都不再改变
⑤体系温度不再改变
A. ②③④ B. ①③⑤ C. ①④⑤ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1000mL硝酸钾和硝酸铜的混合溶液中c(NO3-)=3.0mol/L,用石墨做电极电解此溶液,当通电一段时间后两极均收集到22.4L气体(标准状况)。下列说法正确的是( )
A. 原混合溶液中钾离子浓度为2mol/LB. 上述电解过程中共转移6mol电子
C. 电解得到的铜的物质的量为0.5molD. 电解后溶液中氢离子浓度为2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了酸性高锰酸钾与草酸的反应,记录以下实验数据:
实验编号 | 实验温度 | 试管中所加试剂及其用量 / mL | 溶液褪至无色所需时间/ min | |||
0.6mol/L H2C2O4 溶液 | H2O | 3mol/L H2SO4 稀溶液 | 0.05mol/L KMnO4溶液 | |||
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请写出该反应的离子方程式_________,当该反应以表中数据反应完全时转移电子数为_______NA;
(2)V1=________ mL;
(3)根据上表中的实验①、②数据,可以得到的结论是________。
(4)探究温度对化学反应速率的影响,应选择________(填实验编号);
(5)该小组同学根据经验绘制了n(Mn 2+)随时间变化的趋势如图所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn 2+)随时间变化的实际趋势如图所示。
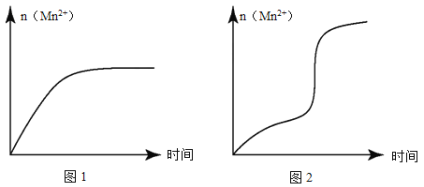
该小组同学根据如图所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再加入某种固体 | 溶液褪至无色所需时间 / min | |||
④ | 25 | 0.6mol/L H2C2O4 | H2O | 3mol/L H2SO4 | 0.05mol/L KMnO4溶液 | ||
2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t | ||
①小组同学提出的假设是_________。
②若该小组同学提出的假设成立,应观察到_______________________现象。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0molL-1的NaOH溶液230mL:
(1)配制溶液时,一般可以分为以下几个步骤:(完成下列空格)
A.计算;B.称量;C.___;D.冷却;E.移液;F.___;G.定容;H.摇匀、装瓶。
(2)本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、量筒、还有___mL容量瓶,使用容量瓶前必须进行的一步操作是___。
(3)需称量___g烧碱固体,固体应该放在___中称量。
(4)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是___。
A.没有洗涤烧杯和玻璃棒
B.转移溶液时不慎有少量洒到容量瓶外面
C.容量瓶不干燥,含有少量蒸馏水
D.定容时俯视刻度线
E.未冷却到室温就将溶液转移到容量瓶并定容
(5)若从所配制溶液取出100mL,再将这100mL溶液加水稀释成1L的溶液,则稀释后所得溶液的物质的量浓度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率和限度的说法中,不正确的是( )
A.实验室用H2O2分解制O2,加入MnO2后,反应速率明显加快
B.在金属钠与足量水反应中,增加水的量能加快反应速率
C.2SO2+O2![]() 2SO3反应中,SO2的转化率不能达到100%
2SO3反应中,SO2的转化率不能达到100%
D.实验室用碳酸钙和盐酸反应制取CO2,用粉末状碳酸钙比块状反应要快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸的关键反应是二氧化硫催化氧化为三氧化硫,其反应方程式2SO2g)+O2(g)![]() 2SO3(g)。回答下列有关问题:
2SO3(g)。回答下列有关问题:
(1)如果此反应用氧气表示的化学反应速率是v(O2)=0.05mol/(L·s),则用二氧化硫表示的v(SO2)=______________.
(2)其它条件不变,若升高温度,此反应会向逆反应方向移动,则正反应速率______________,逆反应速率______________(填增大或减小),正反应是______________反应(填吸热或放热)。
(3)其它条件不变,增大氧气的浓度,会使SO2的转化率______________。
(4)下列条件能够判断此反应已经达到化学平衡状态的是______________
A.单位时间内消耗1molSO2的同时生成1molSO3
B.恒温恒容条件下体系的总压强不在随时间的变化而变化
C.恒温恒容条件下混合气体的密度不再随时间的变化而变化
D.2v(O2)正= v(SO2)逆时
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是H2(g)与I2(g)反应生成HI(g)的能量示意图。由图可知

A.该反应是吸热反应
B.1 mol HI(g)分解吸收的热量为Q
C.热化学方程式:H2+I2![]() 2HI+Q
2HI+Q
D.反应物总能量高于生成物总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门实用性很强的科学。根据题意填空:
(1)古代锻造刀剑时,将炽热的刀剑快速投入水中“淬火”,反应为:3Fe+4H2O(g) ![]() Fe3O4+4H2。该反应中H2O作__________(填“氧化剂”或“还原剂”);
Fe3O4+4H2。该反应中H2O作__________(填“氧化剂”或“还原剂”);
(2)某同学炒菜时发现,汤汁溅到液化气的火焰上时,火焰呈黄色。据此他判断汤汁中含有________(填“钠”或“钾”)元素;
(3)海水提镁的重要步骤之一是用沉淀剂将海水中的Mg2+沉淀。该沉淀剂是__________(填“生石灰”或“盐酸”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com