
下列说法不正确的是( )
①质子数相同的粒子一定是同一种元素
②质子数相同且电子数也相同的两种粒子不可能一种是分子,另一种是离子
③电子数相同的粒子不一定是同种元素
④一种元素不可以形成不同的单质
⑤某元素的相对原子质量取整数值就是质量数
A.②④⑤B.①④⑤ C.②③④ D.①②③④⑤
科目:高中化学 来源:2013-2014山东省淄博市高一下学期期末考试化学试卷(解析版) 题型:填空题
(18分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH与Cl2反应生成的是KClO3。写出在温度较高时KOH与Cl2反应的化学方程式 ,该反应的氧化产物是 。
(2)在溶液Ⅰ中加入KOH固体的目的是 (填编号)。
A.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为KClO
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为 。
(4)如何判断K2FeO4晶体已经洗涤干净 。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:
___FeO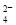 +____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。
+____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济宁市3月质量检测高二化学试卷(解析版) 题型:填空题
(6分)完成下列反应式,并说明反应类型。
(1)丙烯通入溴水中
(2)2—丁烯在催化剂作用下生成聚2—丁烯
(3)由苯制硝基苯 .
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济宁市3月质量检测高一化学试卷(解析版) 题型:填空题
(12分) A、B、C、D、E均为短周期元素,且原子序数依次增大。已知B元素在自然界中组成化合物的种类最多;D原子最外层电子数与核外电子数之比为3:4;A与D、E与D均可组成原子个数比为1:1和2:1的两种化合物。据此回答:
(1)由A、C、D三种元素可组成多种化合物,写出其中两种常见化合物的化学式 。
(2)在C和B组成化合物 (CB)2中,C、B原子均满足最外层8电子结构,,则(CB)2的电子式是 。
(3)化合物E3C与水反应的原理和氮化镁与水反应的原理相同,写出E3C与盐酸反应的化学方程式 。
(4)已知B与A可组成化合物甲,D与A可组成化合物乙,每个甲、乙分子中均含有18个电子
① 甲在过量的D单质中充分燃烧,燃烧热是1559 kJ / mol,写出该反应的热化学方程式 。
② 在酸性条件下,向FeI2的淀粉溶液中加入乙,溶液变蓝。当1mol Fe2+被氧化成Fe3+时,反应中电子转移为4 mol,写出该反应的离子方程式_______________。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济宁市3月质量检测高一化学试卷(解析版) 题型:选择题
用下列实验装置能达到实验目的的是( )
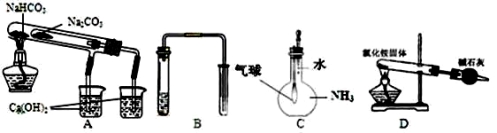
A.比较NaHCO3和Na2CO3热稳定性大小 B.用铜和稀硝酸制取并收集少量NO
C.验证氨气在水中溶解度的大小 D.实验室用氯化铵制少量氨气
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济宁市3月质量检测高一化学试卷(解析版) 题型:选择题
两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前10号元素中,满足上述关系的元素共有 ( )
A.1对B.2对C.3对D.4对
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济宁市高二年级第二学期阶段考试化学试卷(解析版) 题型:实验题
(14分)某学生为测定某烧碱样品中NaOH的质量分数,进行如下实验(已知该样品中含有少量Na2CO3杂质)
a.在250mL的容量瓶中定容,配制成250mL烧碱溶液。
b.用碱式滴定管量取25.00mL烧碱溶液于锥形瓶中,加入足量BaCl2溶液使Na2CO3完全转变成BaCO3后滴入几滴酚酞指示剂;
c.在天平上准确称取烧碱样品10.5g,在烧杯中用蒸馏水溶解;
d.将物质的量浓度为1.000mol/L的标准硫酸溶液装入酸式滴定管中,调节液面,记下开始时的读数然后开始滴定。
e.在锥形瓶下垫一张白纸,滴定至溶液恰好变为无色为止,记下读数。试填空:
(1)正确操作步骤的顺序是(用字母填空)_____→_____→_____→_____→_______.
(2)酸式(碱式)滴定管在使用前需进行的第一步操作是____________,中学化学实验常用仪器中使用前和滴定管使用有相同操作的不同类玻璃仪器还有 、_______。
(3)重复上述滴定操作,记录数据如下:
实验编号 | 标准溶液(H2SO4)(aq) 浓度(mol/L) | 滴定完成时耗酸 体积V(mL) | 待测溶液(NaOH)(aq) 体积V(mL) |
1 | 1.000 | 11.00 | 25.00 |
2 | 1.000 | 12.04 | 25.00 |
3 | 1.000 | 12.18 | 25.00 |
①根据以上数据,可计算出该样品中NaOH的质量分数为__________(保留两位有效数字)。
②上述实验中,下列操作(其它操作正确)会造成结果偏低的有__________________。
A.a步操作中未将溶液冷却至室温就转移到容量瓶中定容。
B.c步操作中,称量药品时,砝码放在左盘,NaOH放在右盘。
C.滴定终点读数时俯视读数。
D.酸式滴定管使用前,未用标准H2SO4溶液润洗。
E.锥形瓶水洗后未干燥就直接盛待测溶液。
③有同学提出将原实验方案中的酚酞指示剂改为甲基橙指示剂,你认为是否可行?________(填“可行”或“不可行”)。如果改用甲基橙为指示剂,则测定结果如何?________(填“偏高” “偏低”或“正确”)
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济宁市高二年级第二学期阶段考试化学试卷(解析版) 题型:选择题
下列物质的水溶液经加热浓缩,蒸干灼烧仍能得到原物质的是( )
A.FeC13 B.Ca(HCO3)2 C.Na[Al (OH)4] D.Na2SO3
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省泰安市高三第二轮复习质量检测理综化学试卷(解析版) 题型:推断题
(12分)【化学——有机化学基础】
化合物Ⅲ具有水果香味,在实验室可通过如下反应制得:
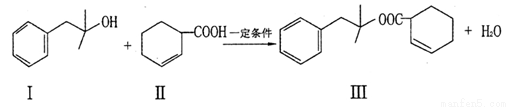
化合物I可通过下列路径合成:
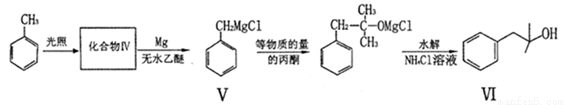
(1)化合物Ⅱ能使Br2的CCl4溶液褪色,其反应化学方程式为 。
(2)化合物Ⅳ的结构简式为 ,生成化合物Ⅳ的反应类型为 。
(3)在浓硫酸和加热条件下,化合物I易发生消去反应生成含2个甲基的产物,该反应化学方程式为 。
(4)写出满足下列条件的化合物Ⅱ的三种同分异构体 、 、 。
①含一个六元环 ②无酸性,酸性条件下水解生成两种有机物 ③能发生银镜反应
(5)CH3CH2MgBr和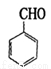 也能发生类似V
也能发生类似V Ⅵ的反应,请写出所生成醇的结构简式 。
Ⅵ的反应,请写出所生成醇的结构简式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com