
取一定量的Na2CO3、NaHCO3和Na2SO4的混合物与250mL 1.00mol•L﹣1过量盐酸反应,生成2.016L CO2(标准状况),然后加入500mL 0.100mol•L﹣1 Ba(OH)2溶液,得到沉淀的质量为2.33g,溶液中过量的碱用10.0mL,1.00mol•L﹣1盐酸恰好完全中和.
求:
(1)n(CO2)= mol;
(2)m(Na2SO4)= g;
(3)m(NaHCO3)= g.
考点:
化学方程式的有关计算.
专题:
计算题.
分析:
(1)根据标况下CO2的体积,计算CO2的物质的量;
(2)Na2CO3、NaHCO3和Na2SO4的混合物与过量盐酸反应后,加入Ba(OH)2溶液后,由于碱过量,则Na2SO4全部生成的沉淀为BaSO4,利用S原子守恒,计算Na2SO4的质量;
(3)利用C原子守恒,根据 CO2的物质的量,计算出Na2CO3和NaHCO3的总物质的量,再利用消耗盐酸的物质的量,分别计算出Na2CO3和NaHCO3的物质的量,得到答案.
解答:
解:(1)CO2的体积为2.016L,则其物质的量为:n= =
=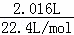 =0.09mol,故答案为:0.09;
=0.09mol,故答案为:0.09;
(2)混合物中Na2SO4的质量= ×142g/mol=1.42g,故答案为:1.42;
×142g/mol=1.42g,故答案为:1.42;
(3)设混合物中Na2CO3和NaHCO3的物质的量分别为x和y,反应中放出的CO2物质的量=0.09mol,与Na2CO3、NaHCO3反应的盐酸的物质的量为:0.250L×1.00mol/L﹣0.500L×0.100mol/L×2+0.0100L×1.00mol/L=0.160mol,则有:
x+y=0.09mol,根据化学方程式:Na2CO3+2HCl=2NaCl+H2O+CO2↑,NaHCO3+HCl=NaCl+H2O+CO2↑,得出:2x+y=0.160mol,解得:x=0.07mol,y=0.02mol,NaHCO3质量=0.02mol×84g/mol=1.68g,故答案为:1.68.
点评:
本题考查了混合物的有关计算及化学方程式的计算,难度不大,应灵活运用原子守恒的观点.


科目:高中化学 来源: 题型:
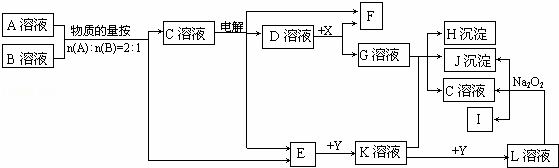
E、F、I标准状况下是气体单质,其中E为有剌激性气味的气体,X、Y是常见的金属单质,参加反应的水以及生成的水在图中已略去.
填写下列空白:
(1)E是 ;J是 .(写化学式)
(2)写出D+X→F+G的离子方程式: .
(3)写出A+B→C+E的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
两个体积相同的密闭容器一个盛氯化氢,另一个盛有H2和Cl2的混合气体,在同温同压下,两个容器内的气体一定具有相同的是( )
|
| A. | 质量 | B. | 密度 | C. | 电子总数 | D. | 原子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)实验操作中,不慎将手指划破,这时可从急救箱中取FeCl3溶液止血,其原理是 .
(2)今有两瓶标签模糊不清,只知道分别盛有淀粉溶液和氯化钠溶液,试用2种方法对其鉴别.
① ;② .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子在溶液中能大量共存的是( )
|
| A. | Fe3+、NH4+、SCN﹣、Cl﹣ | B. | Fe2+、NH4+、Cl﹣、OH﹣ |
|
| C. | Al3+、Na+、OH﹣、Cl﹣ | D. | Na+、H+、NO3﹣、SO42﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关甲苯的实验事实中,能说明侧链对苯环性质有影响的是()
A. 甲苯的硝化反应生成三硝基甲苯
B. 甲苯能使酸性高锰酸钾溶液褪色
C. 甲苯燃烧产生带浓烟的火焰
D. 1mol甲苯与3mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
家用炒菜锅用水清洗后,出现红棕色的锈斑.在此变化过程中不发生的化学反应是()
A. 4Fe(OH)2+2H2O+O2═4Fe(OH)3
B. 2Fe+2H2O+O2═2Fe(OH)2
C. 正极反应:2H2O+O2+4 e﹣→4OH﹣
D. 负极反应:Fe→Fe3++3 e﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com