
分析 无机盐A,加入足量6%的H2O2溶液,充分反应生成水、气态氧化物B,气态单质C,盐D和含氧强酸E;B、C、D、E均通(加)入Ba(OH)2溶液中,B、D、E与Ba(OH)2生成了白色沉淀,再向白色沉淀中加入足量稀硝酸,只有B生成的沉淀溶解且放出气体B,则B为CO2,含氧强酸E为H2SO4,A、D的焰色呈紫色,则含有钾元素,所以D为K2SO4,C在标况下的密度为1.25g/L,则M=ρVm=1.25g/L×22.4L/mol=28g/mol,所以该单质气体为N2,所以A中含有K、C、S、N元素,则A为KSCN;
(1)由分析可知A为KSCN;
(2)KSCN与H2O2反应生成CO2、N2、K2SO4、H2O、H2SO4,KSCN中K为+1价,S为-2价,N为-3价,C为+4价,根据得失电子守恒和原子守恒配平方程式;
(3)CO2与Ba(OH)2反应生成BaCO3和水;
(4)短周期的金属单质R在CO2、N2中都能燃烧,则R为Mg,根据Mg与CO2、N2反应方程式分析;
(5)检验亚铁离子先加KSCN溶液,无现象,再加双氧水,变红色,证明有Fe2+.
解答 解:无机盐A,加入足量6%的H2O2溶液,充分反应生成水、气态氧化物B,气态单质C,盐D和含氧强酸E;B、C、D、E均通(加)入Ba(OH)2溶液中,B、D、E与Ba(OH)2生成了白色沉淀,再向白色沉淀中加入足量稀硝酸,只有B生成的沉淀溶解且放出气体B,则B为CO2,含氧强酸E为H2SO4,A、D的焰色呈紫色,则含有钾元素,所以D为K2SO4,C在标况下的密度为1.25g/L,则M=ρVm=1.25g/L×22.4L/mol=28g/mol,所以该单质气体为N2,所以A中含有K、C、S、N元素,则A为KSCN;
(1)由分析可知A为KSCN,故答案为:KSCN;
(2)KSCN与H2O2反应生成CO2、N2、K2SO4、H2O、H2SO4,KSCN中K为+1价,S为-2价,N为-3价,C为+4价,生成产物中CO2中C为+4价,N2为0价,K2SO4中S为+6价,H2SO4中S为+6价,则配平方程式为:2KSCN+11H2O2=2CO2↑+N2↑+K2SO4+10H2O+H2SO4;
故答案为:2KSCN+11H2O2=2CO2↑+N2↑+K2SO4+10H2O+H2SO4;
(3)CO2与Ba(OH)2反应生成BaCO3和水,其反应的离子方程式为:CO2+Ba2++2OH-=BaCO3↓+H2O,故答案为:CO2+Ba2++2OH-=BaCO3↓+H2O;
(4)短周期的金属单质R在CO2、N2中都能燃烧,则R为Mg,由2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO,N2+3Mg$\frac{\underline{\;点燃\;}}{\;}$Mg3N2,可知1molCO2消耗2molMg,1molN2消耗3molMg,则等体积的B、C完全反应消耗金属单质R的质量比为2:3,故答案为:2:3;
(5)检验亚铁离子用KSCN溶液和双氧水,其操作为:取少量晶体于试管中,加水溶解,滴入KSCN 溶液,无明显现象,再滴加H2O2溶液,溶液变为红色,说明晶体中含有Fe2+,故答案为:取少量晶体于试管中,加水溶解,滴入KSCN 溶液,无明显现象,再滴加H2O2溶液,溶液变为红色,说明晶体中含有Fe2+.
点评 本题考查了物质组成的探究实验,题目难度较大,涉及的知识点较多,注意掌握无机推断的方法与技巧,明确有关化学方程式的书写、计算方法,试题充分考查了学生的分析、理解能力及化学计算能力.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:选择题
| A. | (3m+n)mol | B. | ($\frac{5m}{2}$+$\frac{n}{2}$-3p)mol | C. | ($\frac{5m}{2}$+$\frac{n}{2}$)mol | D. | (3m+n+2p)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中KNO3是氧化剂,N2是还原产物 | |
| B. | 每生成16 mol N2转移30 mol电子 | |
| C. | 若氧化产物比还原产物多1.75mol,则转移电子的物质的量为1.25mol | |
| D. | 该反应中氧化产物与还原产物的质量之比为1:15 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
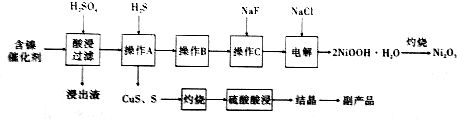
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com