
| X | … | Y |
| Z | … | W |
| A、Z元素的原子半径可能比Y元素小 |
| B、Z元素的最高化合价可能比Y元素的高 |
| C、W的气态氢化物的稳定性一定比Y的强 |
| D、Z的最高价氧化物的水化物的酸性一定比W的强 |


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
 ③CH3CH2Br④
③CH3CH2Br④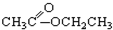 ⑤
⑤ ⑥
⑥ ⑦
⑦ ⑧
⑧ ⑨
⑨ ⑩
⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol | B、1.33mol |
| C、1.67mol | D、0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应速率B>A |
| B、SO2的转化率B>A |
| C、平衡时SO2的百分含量B>A |
| D、平衡时容器的压强B>A |
查看答案和解析>>
科目:高中化学 来源: 题型:
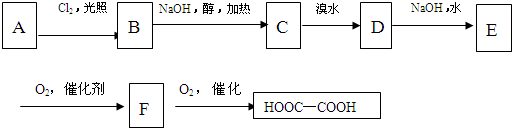
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com