
| A.原子半径:丙>乙>甲 |
| B.最外层电子数:丙=丁 |
| C.气态氢化物的稳定性:甲>丙 |
| D.最高价氧化物对应的水化物的酸性:丁>甲 |
 或②
或②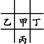 。若是①可设甲的原子序数为x,则乙为x+1,丁为x-1,丙为x+8,则有:x+x+1=x+8,x=7,即甲为N,乙为O,丁为C,丙为P,则四种元素原子的最外层电子数之和为20,符合题意。同理验证②不合题意。原子半径丙(P)>甲(N)>乙(O),A项错误;丙(P)最外层电子数为5,而丁(C)最外层电子数为4,B项错误;甲元素的氢化物为NH3,丙元素对应的氢化物为PH3,显然稳定性前者强,C项正确;最高价氧化物对应的水化物的酸性:HNO3>H2CO3,D项错误。
。若是①可设甲的原子序数为x,则乙为x+1,丁为x-1,丙为x+8,则有:x+x+1=x+8,x=7,即甲为N,乙为O,丁为C,丙为P,则四种元素原子的最外层电子数之和为20,符合题意。同理验证②不合题意。原子半径丙(P)>甲(N)>乙(O),A项错误;丙(P)最外层电子数为5,而丁(C)最外层电子数为4,B项错误;甲元素的氢化物为NH3,丙元素对应的氢化物为PH3,显然稳定性前者强,C项正确;最高价氧化物对应的水化物的酸性:HNO3>H2CO3,D项错误。

科目:高中化学 来源:不详 题型:单选题
| A.元素周期表是元素按原子序数从小到大排列而成的 |
| B.元素原子的电子层数等于其所在周期的周期序数 |
| C.四、五、六周期中都含有18种元素 |
| D.元素周期表中有18列、16个族 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.沸点:NH3>PH3>AsH3 |
| B.熔点:Si3N4>NaCl>SiI4 |
| C.酸性:HClO4>H2SO4>H3PO4 |
| D.碱性:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径:W>Z>Y>X |
| B.Y元素在周期表中的位置为第3周期第ⅣA族 |
| C.1 mol甲与足量的乙完全反应共转移1 mol电子 |
| D.化合物甲中只有离子键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| X | | Y | |
| Z | | W | Q |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | | | | | | X |
| Y | | Z | | | | W |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 原子半径(nm) | 0.102 | 0.110 | 0.117 | 0.074 | 0.075 | 0.071 | 0.099 | 0.077 |
| 最高化合价 | +6 | +5 | +4 | | +5 | | +7 | +4 |
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
 2AD3 ΔH=-47 kJ/mol,在上述平衡体系中加入18D2,当平衡发生移动后,AD2中18D的百分含量________(填“增加”“减少”或“不变”)其原因为______________________________________________
2AD3 ΔH=-47 kJ/mol,在上述平衡体系中加入18D2,当平衡发生移动后,AD2中18D的百分含量________(填“增加”“减少”或“不变”)其原因为______________________________________________
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.Y元素最高价氧化物对应的水化物化学式为H3YO4 |
| B.Y最简单气态氢化物的水溶液显弱碱性 |
| C.原子半径由小到大的顺序为:X<Z<Y<W |
| D.X、Z两种元素的氧化物中所含化学键类型相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com