
| A. | 铝合金的强度和硬度都比纯铝的大 | |
| B. | 铝制的容器可以贮存浓硫酸或浓硝酸 | |
| C. | 铝表面的氧化膜可用盐酸或氢氧化钠溶液除去 | |
| D. | 将金属钠加入到氯化铝溶液中可制得铝 |
分析 A.合金的硬度和强度大于其成分金属;
B.常温下,Al遇到浓硫酸或浓硝酸会钝化;
C.氧化铝具有两性,能溶于强酸或强碱;
D.金属钠与溶液反应时先与水反应.
解答 解:A.合金的硬度和强度大于其成分金属,则铝合金的强度和硬度都比纯铝的大,故A正确;
B.常温下,Al遇到浓硫酸或浓硝酸会钝化,在Al的表面形成致密的氧化膜能保护内部金属,所以铝制的容器可以贮存浓硫酸或浓硝酸,故B正确;
C.氧化铝具有两性,能溶于强酸或强碱,所以铝表面的氧化膜可用盐酸或氢氧化钠溶液除去,故C正确;
D.金属钠与溶液反应时先与水反应,则将金属钠加入到氯化铝溶液中,Na先与水反应生成氢氧化钠,氢氧化钠再与氯化铝反应生成氢氧化铝沉淀,不能制得铝,故D错误.
故选D.
点评 本题考查了合金的性质、铝及其化合物的性质,题目难度不大,侧重于元素化合物性质的考查,注意把握钠与水溶液的反应实质.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  除去CO2中的HCl | B. |  蒸发氯化钠溶液 | ||
| C. |  稀释浓硫酸 | D. |  过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO+H2O═Ca(OH)2 | B. | 2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO | ||
| C. | HCl+NaOH═NaCl+H2O | D. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,⑦的电子式是
,⑦的电子式是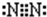 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| S | 112.8 | 444.6 | 略 |
| S2Cl2 | -77 | 137 | 遇水生成HCl、SO2、S 3000C以上完全分解 |

| 实验步骤 | 实验现象和结论 |
| 1.取少量溶液于试管中,滴入几滴KMnO4溶液 | KMnO4溶液颜色由紫色变绿色,说明溶液中大量存在SO32- |
| 2.另取少量溶液于试管中,加入2-3滴酚酞溶液 | 溶液颜色由无色变红,说明溶液中大量存在OH- |
| 3.另取少量溶液于试管中,加入足量1mol•L-1HNO3,再加入少量AgNO3溶液 | 仍有白色沉淀产生,说明溶液中大量存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 I.已知H2(g)、CO(g)和CH3OH(l)的标准燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;
I.已知H2(g)、CO(g)和CH3OH(l)的标准燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com