
如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
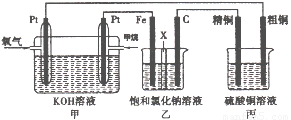
(1)甲烷燃料电池负极电极反应式是:
(2)石墨电极(C)的电极反应式为
(3)若在标准状况下,有2. 24 L氧气参加反应,则乙装置中铁电极上生成的气体体积为_ L;丙装置中阴极析出铜的质量为 g
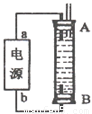
(4)某同学利甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。若用于制漂白液时a为电池_ 极,电解质溶液最好用_ 。若用于制 Fe(OH)2,使用硫酸钠做电解质溶液,阳极选用 作电极。
(1)CH4-8e-+10OH-=CO32-+7H2O
(2)2Cl--2e-=Cl2↑
(3)4.48 12.8
(4)负 饱和氯化钠溶液或食盐水 铁
【解析】
试题分析:甲为燃料电池,甲烷通入一极为负极,氧气通入一极为正极;乙为电解池,Fe为阴极,C为阳极,实质为电解饱和食盐水;丙为电解池,粗铜为阳极,精铜为阴极,实质为精炼铜。
(1)注意在碱性环境中进行的电极反应产物为CO32-;
(2)石墨电极(C)的电极为阳极,阴离子放电;
(3)标准状况下,2.24L氧气的物质的量为0.1mol,参与反应转移电子数为0.4mol ;铁电极为阴极,阳离子放电:2H++2e-=H2,则放出氢气0.2mol,即为4.48L;丙装置中阴极反应式为:Cu2++2e-=Cu,则析出铜0.2mol,即为12.8g。
(4)用于制漂白液时利用电解饱和氯化钠溶液或食盐水,同时利用生成的NaOH溶液吸收生成的Cl2进而生成漂白液,因此Cl2要在B极生成才可被NaOH溶液吸收完全。 用于制Fe(OH)2时需要铁做阳极放电生成亚铁离子:Fe-2e-=Fe2+
考点:电化学的基础知识。


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【化学—选修3:物质结构与性质】(15分)
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
| A元素的核外电子数和电子层数相等,也是原子半径最小的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2 = 1451 kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式
(2)B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,
该同学所画的电子排布图违背了
(4)G位于 族 区,价电子排布式为
(5)DE3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型为
(6)检验F元素的方法是 ,请用原子结构的知识解释产生此现象的原因是
(7)F元素的晶胞如下图所示,若设该晶胞的密度为a g/cm3,阿伏加德罗常数为NA,
F原子的摩尔质量为M,则F原子的半径为 cm
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南省原名校高三下学期第一次联考化学试卷(解析版) 题型:推断题
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题:
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素。
B元素原子的核外p电子数比s电子数少1。
C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451J/mol I3=7733kJ/mol
I4=10540kJ/mol
D原子核外所有p轨道全满或半满。
E元素的主族序数与周期数的差为4。
F是前四周期中电负性最小的元素。
G在周期表的第七列。
(1)已知BA5为离子化合物,写出其电子式__________________________________。
(2)B的基态原子中能量最高的电子,其电子云在空间有①_________个伸展方向,原子轨道呈②__________________形。
(3)某同学根据上述信息,推断C的基态原子的核外电子排布图为:
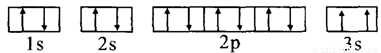
该同学所画的电子排布图违背了_________________________。
(4)G位于①_________族②________区,价电子排布式为③______________________。
(5)DE3分子中,中心原子的杂化方式为①_____________,其分子的立体构型为②_____________。
(6)F晶体的晶胞如下图所示,若设该晶胞的密度为ag·cm-3,阿伏加德罗常数为NA,F原子的摩尔质量为M,则F原子的半径为_____________cm。

查看答案和解析>>
科目:高中化学 来源:2011-2012学年陕西省高三第七次模拟考试化学试卷(解析版) 题型:填空题
【化学—选修3:物质结构与性质】(15分)
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
|
A元素的核外电子数和电子层数相等,也是原子半径最小的元素 |
|
B元素原子的核外p电子数比s电子数少1 |
|
C原子的第一至第四电离能分别是: I1=738kJ/mol I2 = 1451 kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
|
D原子核外所有p轨道全满或半满 |
|
E元素的主族序数与周期数的差为4 |
|
F是前四周期中电负性最小的元素 |
|
G在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式
(2)B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,
该同学所画的电子排布图违背了
(4)G位于 族 区,价电子排布式为
(5)DE3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型为
(6)检验F元素的方法是 ,请用原子结构的知识解释产生此现象的原因是
(7)F元素的晶胞如下图所示,若设该晶胞的密度为a g/cm3,阿伏加德罗常数为NA,
F原子的摩尔质量为M,则F原子的半径为 cm

查看答案和解析>>
科目:高中化学 来源:专项题 题型:填空题
 2B(g)。在三种不同条件下进行实验,A的物质的量随时间的变化如下图所示。试回答下列问题:
2B(g)。在三种不同条件下进行实验,A的物质的量随时间的变化如下图所示。试回答下列问题: 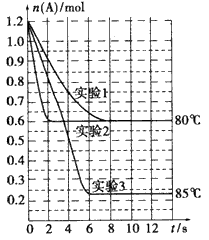

查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g) + O2(g)![]() 2SO3(g) ΔH= —Q1 kJ·mol-1
2SO3(g) ΔH= —Q1 kJ·mol-1
2NO(g) + O2(g)![]() 2NO2(g) ΔH= —Q2kJ·mol-1
2NO2(g) ΔH= —Q2kJ·mol-1
则反应NO2(g) + SO2(g)![]() SO3(g) + NO(g) 的ΔH= kJ·mol-1。
SO3(g) + NO(g) 的ΔH= kJ·mol-1。
 (2)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生
(2)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生
上述反应, 当测得上述反应平衡时NO2与NO体积比为1:3,
则平衡常数K= 。
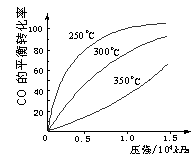
(3)CO可用于合成甲醇,反应方程式为:
CO(g)+2H2(g)![]() CH3OH(g)。CO在不同温度下的
CH3OH(g)。CO在不同温度下的
平衡转化率与压强的关系如下图所示。该反应ΔH 0
(填“>”或“ <”)。
Ⅱ.已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。
(1)用离子方程式解释Na2C2O4溶液显碱性的原因 ;
(2)常温下,比较0.1 mol·L-1NaHC2O4溶液中各种离子浓度的大小关系 ;
Ⅲ.某课外活动小组为了探究的BaSO4溶解度,分别将足量BaSO4放入:a. 5ml 水;b. 40 ml 0.2 mol·L-1的Ba(OH)2溶液;c. 20ml 0.5 mol·L-1的Na2SO4溶液;d. 40ml 0.1 mol·L-1的H2SO4溶液中,溶解至饱和。
(1)以上各溶液中,的浓度由大到小的顺序为 ;
A.b>a>c>d B.b>a>d>c C.a>d>c>b D.a>b>d>c
(2)某同学取同样的溶液b和溶液d直接混合,则混合溶液的pH值为 (设混合溶液的体积为混合前两溶液的体积之和)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com