
| 容器 | SO2(mol) | O2(mol) | N2(mol) | Q(kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 1 | 0.5 | 1 | Q3 |
| A、Q2=98.5 kJ |
| B、2SO2(g)+O2(g)?2SO3(s);△H>-197KJ/mol |
| C、丙容器中压强大于乙,所以丙的反应速率大于乙 |
| D、2Q3<Q1<197KJ |


科目:高中化学 来源: 题型:
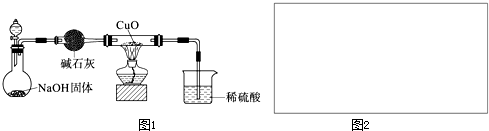
查看答案和解析>>
科目:高中化学 来源: 题型:
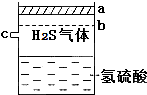 已知多元弱酸在水溶液中的电离是分步进行的,且第一步的电离程度大于第二步的电离程度,第二步的电离程度远大于第三步的电离程度…在密闭容器里盛有饱和H2S溶液和H2S气体,可上下移动的活塞停止在a处,如图所示.
已知多元弱酸在水溶液中的电离是分步进行的,且第一步的电离程度大于第二步的电离程度,第二步的电离程度远大于第三步的电离程度…在密闭容器里盛有饱和H2S溶液和H2S气体,可上下移动的活塞停止在a处,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分别加入碘水,观察颜色反应 |
| B、分别加热,观察是否生成沉淀 |
| C、加入淀粉酶观察是否水解 |
| D、分别灼烧,闻味道 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蔬菜最好洗干净后再切 |
| B、炒蔬菜的时间不能太长,炒熟即可 |
| C、新鲜蔬菜应放在冰箱中储存 |
| D、把蔬菜放在高压锅中焖煮 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过量的铁在氯气中燃烧可生成氯化亚铁 |
| B、向Fe(NO3)2溶液加入盐酸,由于酸性增强抑制Fe2+的水解,使c(Fe2+)增大 |
| C、Fe和Fe2O3的混合物溶于盐酸中,再加入KSCN溶液,溶液一定变为血红色 |
| D、把一定量的铁和铜的混和粉未投入到FeCl3溶液中,不可能出现只有铁剩余没有铜剩余的情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、MnO4-、Na+、Cl- |
| B、Na+、H+、NO3-、SO42- |
| C、Fe3+、Na+、Cl-、SO42- |
| D、K+、Na+、NO3-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com