
实验室从含碘废液(除H2O外,含有CCl4, I2, I-等)中回收碘,其实验过程如下:
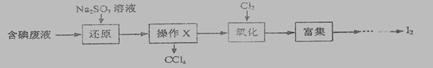
(1)操作x的名称为________________。主要的仪器是_______________________。
(2)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的 I2 还原为I-,其离子方程式为_________;该操作的目的是____________________。
(3)①在测定亚硫酸钠溶液浓度时,量取25.00mL亚硫酸钠溶液,用0.10mol·L-1的酸性高锰酸钾溶液进行滴定,下列说法正确的是_________________。
A.润洗滴定管时,应从滴定管上口加满所需的试液,使滴定管内壁充分润洗
B.高锰酸钾溶液装在酸式滴定管中,本实验无需外加指示剂
C.滴定时,眼睛注视滴定管中液面的变化
D.滴定开始时读数正确,滴定终点仰视读数,会使实验误差偏高
②达到滴定终点时,消耗高锰酸钾溶液18.00mL,则亚硫酸钠溶液的浓度为________________。
【知识点】氧化还原反应、离子反应方程式,滴定操作B2 B1
【答案解析】(1) 分液 (1分) 分液漏斗(答出分液漏斗就得分) (1分)
(2)SO32-+I2+H2O=2I-+SO42-+2H+ (2分) 使四氯化碳当中的碘单质进入水溶液中(2分)
(3)①B、D(2分,漏答给1分,错答不给分) ②c(Na2SO3)==0.18 mol·L-1(2分)
解析:(1)四氯化碳属于有机物、水属于无机物,二者不互溶,分离互不相溶的液体采用分液的方法分离,所以分离出四氯化碳采用分液的方法,使用的仪器是分液漏斗;
(2)碘具有氧化性,能氧化亚硫酸钠生成硫酸钠,自身被还原生成碘,离子反应方程式为SO32-+I2+H2O=2I-+2H++SO42-;由于碘不容易溶于水,但碘离子易溶于水,为了使更多的I元素进入水溶液应将碘还原为碘离子;
(3)①A.润洗滴定管时,不需要加满所需的试液,故错误;
B.高锰酸钾溶液有强氧化性,能氧化橡胶管,所以高锰酸钾溶液装在酸式滴定管中,由于反应过程中溶液的颜色会发生变化,本实验无需外加指示剂,故正确;
C.滴定时,眼睛注视锥形瓶中溶液颜色的变化,故错误;
D.滴定开始时读数正确,滴定终点仰视读数,导致读取的高锰酸钾溶液体积偏大,会使实验误差偏高,故正确;
②根据电子守恒,得到关系式:
5Na2SO3----- 2KMnO4
5 2
0.025c 0.1×0.018
解得:c=0.18 (mol·L-1)
【思路点拨】本题以物质的制备为载体考查了氧化还原反应、离子反应方程式,滴定操作等,最后的计算根据电子守恒,得到关系式:5Na2SO3----- 2KMnO4是关键。


科目:高中化学 来源: 题型:
下列有关说法正确的是
A.汤姆生、卢瑟福、道尔顿和门捷列夫等对原子结构模型的建立均作出了巨大贡献
B.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底
C.用原子吸收光谱测定化学反应速率
D.科学家已从石墨晶体中剥离出单层的石墨片制得石墨烯,石墨烯是迄今发现的强度最大的高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10mL浓度为0.1mo1·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中
A.水的电离程度始终增大
B.c(NH4+) / c (NH3·H2O)先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+x B(g) 2 C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是:
2 C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是:
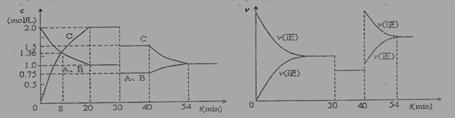
A.30min时降低温度,40min时升高温度
B.30min时,向容器内再充入一定量的C,重新达到平衡时,A的体积分数不变
C.反应方程式中的x=1,正反应为吸热反应
D.8min前,C的平均反应速率为0.08 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
“1mol/L的Na2SO4溶液”的含义是 ( )
A.1L水中有1mol Na2SO4 B.1L溶液中含有142g Na2SO4
C.SO4 2-的物质的量浓度为2 mol/L D.1LNa2SO4溶液中含有Na+ 1 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com