
Na2FeO4是一种高效多功能水处理剂,一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列说法中不正确的是( )。
A.Na2O2在上述反应中既作氧化剂又作还原剂
B.Na2FeO4既是氧化产物又是还原产物
C.Na2FeO4处理水时,既能杀菌,又能在处理水时产生胶体净水
D.2 mol FeSO4发生反应时,共有8 mol电子发生转移
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
短周期主族元素A、B、C、D、E的原子序数依次增大,其中只有C是金属元素,B是地壳中含量最多的元素,A元素常见化合价为+ 1和-1;A与C的最外层电子数相同,C、D两元素原子的电子数之和为A、B两种元素原子的电子数之和的3倍。下列叙述正确的是
1和-1;A与C的最外层电子数相同,C、D两元素原子的电子数之和为A、B两种元素原子的电子数之和的3倍。下列叙述正确的是
A.元素的原子半径:A<B<C< D< E
B.对应氢化物的热稳定性:D > E
C.B与C、B与D形成的化合物中化学键类型相同
D.五种元素中最高价氧化物对应的水化物酸性最强的是E
查看答案和解析>>
科目:高中化学 来源: 题型:
今有三个氧化还原反应: ①2FeCl3+2KI===2FeCl2+2KCl+I2
②2FeCl2+Cl2===2FeCl3 ③2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
若某溶液中有Fe2+、I-、Cl-共存,要除去I-而不氧化Fe2+和Cl-,则可加入的试剂是( )
A.Cl2 B.KMnO4 C.FeCl3 D.HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
小美在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连环物质间不能
发生反应。你认为“五连环”中物质间发生的反应,没有涉及的基本反应类型和属于氧化还原反应的个数有 ( )。
A.复分解反应、1个 B.分解反应、2个
C.化合反应、3个 D.置换反应、2个
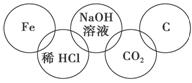
查看答案和解析>>
科目:高中化学 来源: 题型:
与铁相似,金属锡能溶于盐酸生成氯化亚锡,氯化亚锡又能被氯化铁氧化为氯化锡。则下列有关微粒氧化、还原能力的比较中,正确的是( )
A.氧化能力:Sn4+<Sn2+ B.氧化能力:Fe3+<Sn4+
C.还原能力:Fe2+<Sn2+ D.还原能力:Fe<Sn
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是( )
A.含氧酸起氧化作用,无氧酸则不能 B.还原剂在反应中得电子
C.还原剂在反应中发生氧化反应 D.氧化剂在同一反应中既可以是反应物,也可以是生成物
查看答案和解析>>
科目:高中化学 来源: 题型:
磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O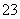 +O2+xOH-===Fe3O4+S4O
+O2+xOH-===Fe3O4+S4O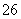 +2H2O。请回答下列问题。
+2H2O。请回答下列问题。
(1)水热法制备Fe3O4纳米颗粒的反应中,还原剂是_________。(2)反应的化学方程式中x=______。
(3)每生成1 mol Fe3O4,反应转移的电子为________mol,被Fe2+还原的O2的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知可逆反应:M(g)+N(g)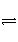
 P(g)+Q(g) ΔH>0,请回答下列问题:
P(g)+Q(g) ΔH>0,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c0(M)=1 mol·L-1,c0(N)=2.4 mol·L-1;达到平衡后,M的转化率为60%,此时N的转化率为________;
(2)若反应温度升高,M的转化率________(填“增大”、“减小”或“不变”);
(3)若反应温度不变,反应物的起始浓度分别为:c0(M)=4 mol·L-1,c0(N)=a mol·L-1;达到平衡后,[P]=2 mol·L-1,a=________;
(4)若反应温度不变,反应物的起始浓度为:c0(M)=c0(N)=b mol·L-1,达到平衡后,M的转化率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com