
下图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。
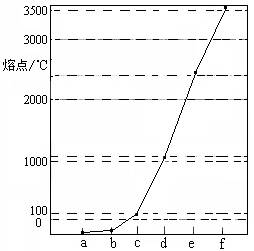
(1)请写出上图中d单质对应元素原子的电子排布式 。
(2)单质a、b、f对应的元素以原子个数比1:1:1形成的分子中含 个![]() 键, 个
键, 个![]() 键。
键。
(3)a与b的元素形成的10电子中性分子X的空间构型为 ;将X溶于水后的溶液滴入到含d元素高价离子的溶液中至过量,生成的含d元素离子的化学式为 ,其中X与d的高价离子之间以 键组合。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
⑴O、Si、N元素的电负性由大到小的顺序是____________________。C60和金刚石都是碳的同素异形体,二者中熔点较高的是____________。
⑵A为短周期金属元素,依据下表数据,A的基态原子的轨道表示式为
________________________________。
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
⑶过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道的电子排布有关。一般地,若为d0或d10排布时,无颜色;若为d1~d9排布时,有颜色;如[Cu(H2O)4]2+显蓝色。据此判断25号元素Mn形成的络合离子[Mn(H2O)6]2+_____(填“有”或“无”)颜色。
⑷H-C≡C-COOH分子内含有的σ键、π键的个数依次为_______________,其中碳原子的杂化方式为___________________。
⑸CO可以与金属铁形成配合物分子Fe(CO)5。Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g),反应过程中,断裂的化学键只有配位键,则形成的化学键的类型是______________。
⑹W元素的原子的M能层为全充满状态,且核外的未成对电子只有一个,W晶体中微粒的堆积方式是下图中 (选填“甲”、“乙”或“丙”);若W晶体中一个晶胞的边长为a cm,则W晶体的密度为 (写出含a的表达式,用NA表示阿伏加德罗常数)。
甲 乙 丙
查看答案和解析>>
科目:高中化学 来源:2012届江苏省如皋中学高三下学期质量检测化学试卷 题型:填空题
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
⑴O、Si、N元素的电负性由大到小的顺序是____________________。C60和金刚石都是碳的同素异形体,二者中熔点较高的是____________。
⑵A为短周期金属元素,依据下表数据,A的基态原子的轨道表示式为
________________________________。
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |



查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省荆门市高三元月调考理综化学试卷(解析版) 题型:填空题
Ⅰ.沿海地区有着丰富的海水资源,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。合理利用资源和保护环境是可持续发展的重要保证。
 (1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式???????????????????????????????? 。
(1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式???????????????????????????????? 。
(2)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水。排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入?????????? (选填“Na2S”或“NaOH”)效果更好。
难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |
(3)火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题。利用海水脱硫是一种有效的方法,其工艺流程如下图所示:

①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因????????? (任写一个)。
②某研究小组为探究提高含硫烟气中SO2吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如图所示。

请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议:??? 。
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,使用氧气将其氧化的化学原理是?????????????????? (任写一个化学方程式或离子方程式)。氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是???????????????????????? 。
Ⅱ.能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式
①2H2(g)+O2(g)=2H2O(l)????  H=-570kJ/mol;
H=-570kJ/mol;
②H2(g)+1/2O2(g)=H2O(g)???  H=-242kJ/mol;
H=-242kJ/mol;
③C(s)+1/2O2(g)=CO(g)????  H=—110.5kJ/moL;
H=—110.5kJ/moL;
④C(s)+O2(g)=CO2(g)???????  H=—393.5kJ/moL;
H=—393.5kJ/moL;
⑤CO2(g)+2H2O(g)=2CH4(g)+2 O2(g)?  H=+890kJ/moL
H=+890kJ/moL
回答下列问题
(1)上述反应中属于吸热反应的是??????????????? 。
(2)H2的燃烧热为△H=??????????????? 。
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测定,但可通过间接的方法求得。已知C(s) + H2O(g)=H2(g)+ CO(g)????  H=akJ/moL;则a=???????? ;该反应的熵
H=akJ/moL;则a=???????? ;该反应的熵 S???????? 0(选填“>”、“=”、“<”);已知自由能
S???????? 0(选填“>”、“=”、“<”);已知自由能 G=
G= H—T
H—T S,当
S,当 G<0时可自发进行。则该反应在什么条件下可自发进行__________________。
G<0时可自发进行。则该反应在什么条件下可自发进行__________________。
(4)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是????? 。

A.负极的电极反应式为:CO+O2—―2e-=CO2
B.工作时电极b作正极,O2—由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省临沂市高三5月高考模拟理综化学试卷(解析版) 题型:填空题
金属铜广泛地应用于电气、机械制造、国防等领域。
(1)Cu是元素周期表中第29号元素,写出第三周期基态原子未成对电子数与Cu相同且电负性最大的元素是 (填元素名称)。
(2)CuO受热易分解为Cu2O和O2,请从铜的原子结构来说明CuO受热易分解的原因:
。
(3)下图是铜的某种氧化物的晶胞示意图。已知该晶胞的边长为a cm,阿伏加德罗常数为NA,该晶体的密度为 。

(4)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,在滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀。
①SO42-中S原子的杂化方式为 。
②NH3分子内的H—N—H键角 (填“大于”“等于”或“小于”)H2O分子内的H—O—H键角。
③S、N、O三种元素第一电离能由大到小的顺序为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三下学期质量检测化学试卷 题型:填空题
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
⑴O、Si、N元素的电负性由大到小的顺序是____________________。C60和金刚石都是碳的同素异形体,二者中熔点较高的是____________。
⑵A为短周期金属元素,依据下表数据,A的基态原子的轨道表示式为
________________________________。
|
电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
|
A |
932 |
1821 |
15390 |
21771 |
⑶过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道的电子排布有关。一般地,若为d0或d10排布时,无颜色;若为d1~d9排布时,有颜色;如[Cu(H2O)4]2+显蓝色。据此判断25号元素Mn形成的络合离子[Mn(H2O)6]2+_____(填“有”或“无”)颜色。
⑷H-C≡C-COOH分子内含有的σ键、π键的个数依次为_______________,其中碳原子的杂化方式为___________________。
⑸CO可以与金属铁形成配合物分子Fe(CO)5。Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g),反应过程中,断裂的化学键只有配位键,则形成的化学键的类型是______________。
⑹W元素的原子的M能层为全充满状态,且核外的未成对电子只有一个,W晶体中微粒的堆积方式是下图中 (选填“甲”、“乙”或“丙”);若W晶体中一个晶胞的边长为a cm,则W晶体的密度为 (写出含a的表达式,用NA表示阿伏加德罗常数)。



甲 乙 丙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com