
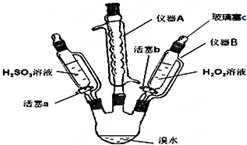
 为了探究H2O2、H2SO3和Br2氧化性的相对强弱,设计如下实验(夹持仪器已略去).请回答下列问题:
为了探究H2O2、H2SO3和Br2氧化性的相对强弱,设计如下实验(夹持仪器已略去).请回答下列问题:| 步骤 | 实验操作 | 实验现象 | 实验结论 |
| Ⅰ | 打开活塞a,逐滴加入H2SO3溶液至过量 | 橙黄色褪去 | Br2的氧化性大于H2SO3 |
| Ⅱ | 向步骤Ⅰ所得溶液中逐滴加入H2O2溶液 | 刚开始溶液颜色无明显变化,继续滴加,溶液变为橙黄色 | H2O2的氧化性大于Br2 |
分析 (1)由A的结构特征可知为球形冷凝管,溴易挥发,冷凝回流溴;
(2)滴液漏斗和三颈瓶相通,气压相等;
(3)Ⅰ:打开活塞a,逐滴加入H2SO3溶液至过量,H2SO3被溴水氧化;
Ⅱ:向步骤Ⅰ所得溶液中逐滴加入H2O2溶液,溶液又变为橙黄色,说明过氧化氢将溴离子氧化为溴单质;
(4)步骤Ⅱ中,开始时颜色无明显变化,可能是因为步骤1的H2SO3有过量,H2O2先和H2SO3反应,或H2O2浓度小或Br-与H2O2反应慢等.
解答 解:(1)仪器A的名称是球形冷你管,其作用是使溴蒸汽冷凝回流,
故答案为:球形冷凝管;冷凝回流溴,以免溴挥发;
(2)用仪器B滴加液体并不需要打开玻璃塞c,原因是该仪器与三颈瓶相通,气压相等,液体能顺利流出,
故答案为:滴液漏斗和三颈瓶相通,气压相等;
(3)Ⅰ:打开活塞a,逐滴加入H2SO3溶液至过量,H2SO3被溴水氧化,溶液的橙黄色褪去,说明溴单质的氧化性强于亚硫酸;
Ⅱ:向步骤Ⅰ所得溶液中逐滴加入H2O2溶液,溶液又变为橙黄色,说明过氧化氢将溴离子氧化为溴单质,则H2O2的氧化性大于Br2,
故答案为:
| 步骤 | 实验操作 | 实验现象 | 实验结论 |
| Ⅰ | 打开活塞a,逐滴加入H2SO3溶液至过量 | 橙黄色褪去 | Br2的氧化性大于H2SO3 |
| Ⅱ | 向步骤Ⅰ所得溶液中逐滴加入H2O2溶液 | 刚开始溶液颜色无明显变化,继续滴加,溶液变为橙黄色 | H2O2的氧化性大于Br2 |
点评 本题考查物质性质探究实验,涉及到元素化合物性质、对装置与原理的分析评价、离子方程式书写、氧化还原反应等,关键是对实验原理的理解,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Na+、OH-、HCO3- | B. | Ag+、Fe3+、Cl- | C. | NH4+、K+、OH- | D. | Ba2+、OH-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 2min | 4min | 6min | 8min | ′′′ | |
| CO | 0.07 | 0.06 | 0.04 | 0.05 | ′′′ |
| H2 | x | 0.12 | 0.12 | 0.2 | ′′′ |
| CH2OH | 0.03 | 0.04 | 0.04 | 0.05 | ′′′ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO4 KNO3 Na2CO3 NH4Cl | B. | H2SO4 BaCl2 Na2SO4 NaOH | ||
| C. | MgCl2 AgNO3 KNO3 HCl | D. | NH4HCO3 NaOH NaCl HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知0.1 mol•L-1的醋酸溶液中存在电离平衡:CH3COOH?CH3COO-+H+,加少量烧碱溶液可使溶液中c(H+)/c(CH3COOH)值增大 | |
| B. | 25℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O?H++OH-逆向移动,c(H+)降低 | |
| C. | 取c(H+)=0.01mol/L的盐酸和醋酸各100mL,分别稀释2倍后,再分别加入 0.03g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大 | |
| D. | 常温下,将pH=11的Ba(OH)2溶液加水稀释10倍后,溶液的pH=12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com