
 锂和铍单质及化合物的性质具有特殊性.
锂和铍单质及化合物的性质具有特殊性.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:


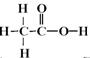
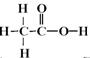
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2010—2011学年福建省三明一中、二中高一下学期联考化学试卷 题型:填空题
(共12分)I.(6分)按要求在下列空格中填出下列有机物的有关式子:
相对分子质量最小的有机物电子式 ,食醋中的有机物结构式 ,糖尿病患者尿液中含的糖类结构简式 。
II.(6分)铍和铝、锂和镁等在元素周期表中具有特殊的“对角线关系”,单质及化合物的性质十分相似。请按要求回答下列各问:
(1)写出Be与NaOH溶液反应的离子方程式(生成Na2BeO2): ;(2)Be(OH)2与Mg(OH)2可用试剂 鉴别,其离子方程式为: ;
查看答案和解析>>
科目:高中化学 来源:2015届福建省高二上学期期中考试化学试卷(解析版) 题型:填空题
锂和铍单质及化合物的性质具有特殊性。
I.石墨可以用作锂电池的负极材料,Li+嵌入石墨层间,形成LiC6嵌入式化合物,正极材料常用LixCoO2。
(1)电负性Li Be(填“>”或“<”)。
(2)Co元素基态原子核外价电子排布式为 。
(3)在LiC6中,Li+与相邻石墨六元环的作用力类型为 。
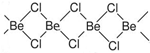
II.固体氯化铍结构如图:
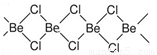
(4)铍原子杂化轨道类型为 。
(5)氯化铍分子中含有化学键类型有 (填序号)。
A.极性键 B.非极性键 C.配位键 D.离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com