
����Ŀ�������İ���ͭ����![]() ������ɱ�����ýȾ�����ڼ��Զ�ͭ��Ҳ���������Һ����Ҫ�ɷ֣��ڹ�ҵ����;�㷺�������¸���������ˮ���������Ҵ������ѣ��ڿ����в��ȶ�������ʱ�����ֽ⡣ij��ѧ��ȤС����Cu�ۡ�3mol/L�����ᡢŨ��ˮ��10% NaOH��Һ��95%���Ҵ���Һ��0.500 mol/Lϡ���ᡢ0.500 mol/L��NaOH��Һ���ϳ������İ���ͭ���岢�ⶨ�䴿�ȡ�
������ɱ�����ýȾ�����ڼ��Զ�ͭ��Ҳ���������Һ����Ҫ�ɷ֣��ڹ�ҵ����;�㷺�������¸���������ˮ���������Ҵ������ѣ��ڿ����в��ȶ�������ʱ�����ֽ⡣ij��ѧ��ȤС����Cu�ۡ�3mol/L�����ᡢŨ��ˮ��10% NaOH��Һ��95%���Ҵ���Һ��0.500 mol/Lϡ���ᡢ0.500 mol/L��NaOH��Һ���ϳ������İ���ͭ���岢�ⶨ�䴿�ȡ�
I��CuSO4��Һ���Ʊ�
�ٳ�ȡ4gͭ�ۣ���A����������10���Ӳ����Ͻ��裬������ȴ��
�����������м���30mL 3mol/L�����ᣬ��A�й��������������У����Ȳ����Ͻ��衣
�۳��ȹ��˵���ɫ��Һ��
(1)A����������Ϊ____��
(2)ijͬѧ��ʵ������1.5g��ͭ��ʣ�࣬��ͬѧ���Ƶõ�CuSO4��Һ������һ�������м���Ũ�����о�Ĥ���֣���ȴ�����ľ����к��а�ɫ��ĩ���Խ�����ԭ��_____
II��������Ʊ�
�������Ʊ���CuSO4��Һ����ͼ��ʾ���в���
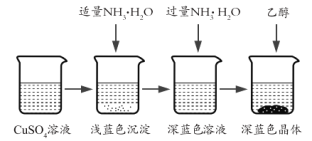
(3)��֪dz��ɫ�����ijɷ�Ϊ![]() ����д�����ɴ˳��������ӷ�Ӧ����ʽ_________��
����д�����ɴ˳��������ӷ�Ӧ����ʽ_________��
(4)��������ʱ���ü����Ҵ��ķ�����������Ũ���ᾧ��ԭ����__��
III���������IJⶨ
��ȷ��ȡmg���壬������ˮ�ܽ⣬ע����ͼ��ʾ������ƿ�У�Ȼ����μ���VmL10%NaOH��Һ��ͨ��ˮ����������ƷҺ�еİ�ȫ����������������ˮ��ϴ�����ڱڣ���V1mL C1mol/L���������Һ��ȫ���ա�ȡ�½���ƿ����C2mol/L NaOH����Һ�ζ���ʣ��HCl(ѡ�ü�����ָʾ��)�����յ�ʱ����V2mLNaOH��Һ��
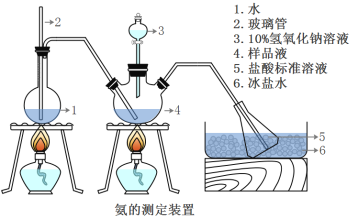
(5)Aװ���г������ܵ�����_____����Ʒ�а������������ı���ʽ_______��
(6)����ʵ���������ʹ�������ⶨ���ƫ�͵�ԭ����_______��
A���ζ�ʱδ��NaOH����Һ��ϴ�ζ���
B������ʱ���ζ�ǰƽ�ӣ��ζ�����
C���ζ�������ѡ�÷�̪��ָʾ��
D��ȡ�½���ƿǰ��δ������ˮ��ϴ�������ƿ�еĵ�����ڡ�
���𰸡����� ��Ӧ�������������Ũ�������У�ϡ�����Ũ��Ũ�������ˮ��ʹCuSO4��5H2Oʧȥ�ᾧˮ��ΪCuSO4 2Cu2++2NH3��H2O+SO42-=Cu2(OH)2SO4+2NH4+ Cu(NH3)4SO4��H2O�����������ȷֽ� ƽ����ѹ����ֹ�����͵��� ![]() BD
BD
��������
��1�����չ��壬Ӧ�������н��У���������AΪ�������ʴ�Ϊ��������
��2���õ���Ϊ����ͭ��������Һ��Ũ��ʱ�������Ũ��Ũ���������ˮ�ԣ�ʹCuSO4��5H2Oʧȥ�ᾧˮ��ΪCuSO4����ʹ�����Ϊ��ɫ���ʴ�Ϊ����Ӧ�������������Ũ�������У�ϡ�����Ũ��Ũ�������ˮ��ʹCuSO4��5H2Oʧȥ�ᾧˮ��ΪCuSO4��
��3��dz��ɫ�����ijɷ�ΪCu2(OH)2SO4������ԭ���غ��֪��Ӧ�����ӷ���ʽΪ2Cu2++2NH3��H2O+SO42-=Cu2(OH)2SO4+2NH4+���ʴ�Ϊ��2Cu2++2NH3��H2O+SO42-=Cu2(OH)2SO4+2NH4+��
��4����������ʱ���ü����Ҵ��ķ�����������Ũ���ᾧ��ԭ����Cu(NH3)4SO4��H2O�����������ȷֽ⣬�ʴ�Ϊ��Cu(NH3)4SO4��H2O�����������ȷֽ⡣
��5��Aװ���г������ܿ���ƽ����ѹ����ֹ�����͵��������ã��백����Ӧ��n(HCl)=10-3V1L��0.5mol/L-10-3V2L��0.5mol/L=0.5��10-3(V1-V2)mol�����ݰ�����HCl�Ĺ�ϵʽ��֪��n(NH3)=n(HCl)= 0.5��10-3(V1-V2)mol������Ʒ�а�����������Ϊ![]() ���ʴ�Ϊ��ƽ����ѹ����ֹ�����͵�����
���ʴ�Ϊ��ƽ����ѹ����ֹ�����͵�����![]() ��
��
��6������������ⶨ���ƫ�ߣ���V2ƫС��
A.�ζ�ʱδ��NaOH����Һ��ϴ�ζ��ܣ�Ũ��ƫ�ͣ���V2ƫ����ƫ�ͣ���A����
B.����ʱ���ζ�ǰƽ�ӣ��ζ����ӣ�����V2ƫС������ƫ�ߣ���B��ȷ��
C.�ζ�������ѡ�÷�̪��ָʾ������ʵ��û��Ӱ�죬��C����
D.ȡ�½���ƿǰ��δ������ˮ��ϴ�������ƿ�еĵ�����ڣ���������ƫ�٣���Ҫ����������ƫ�٣���V2ƫС������ƫ�ߣ���D��ȷ��
�ʴ�Ϊ��BD��


 ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д�
ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д� â���̸����������������ϵ�д�
â���̸����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڰ����ӵ�������˵���в���ȷ���ǣ� ��
A.6.02��1023���������ӵ�����
B.12g12C���е�̼ԭ�������ǰ����ӵ�������ֵ
C.���а����ӵ�����ֵ������������1mol
D.1.5molH2O����9.03��1023��ˮ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10�֣���Ԫ������Ȼ������Ҫ��������������Ҫ�ɷ�ΪAl2O3��������Fe2O3��FeO��SiO2���С���ҵ�����������Ʊ�����ij�ֻ�����Ĺ����������¡�

��1������ҺA�м���Ư��Һ��Ŀ��������������������ҺB�����ԡ�
�ټ�����ҺB���Ƿ�����Ԫ�صķ���Ϊ�� ��ע���Լ�������
�ڽ���ҺB�е���Ԫ���Գ�����ʽ��������ѡ�õ�����Լ�Ϊ ������ţ���
a������������Һ b��������Һ c����ˮ d��������̼
������ҺB�Ʊ��Ȼ��������漰�IJ���Ϊ���ߵμ�Ũ���������Ũ������ȴ�ᾧ��
����������ƣ���ϴ�ӡ�
�ܸù������漰ij������ԭ��Ӧ���£��������ƽ��
Fe2++ ClO��+ = Fe(OH)3��+ C1��+
��2��SiO2��NaOH�����Ʊ������ƣ��ɲ��õ�װ��Ϊ ������ţ���

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����÷Ͼɶ�п��Ƥ���Ʊ�����Fe3O4�������Ӽ�������ZnO,�Ʊ�������ͼ��ʾ��

(1)������ͼ��֪,Zn��Fe������NaOH��Һ��Ӧ����________��
(2)Zn(OH)2�������ȿɵ�ZnO,�÷�Ӧ______����������������������������ԭ��Ӧ��
(3)�������м���ϡH2SO4������Ӧ�����ӷ���ʽ��_________��
(4)��������H2O2��Ŀ����_________��
(5)���֤����������Fe3O4����? _________��
(6)�����������������Һ�ɽ�����(H2SO4��SO3)����ˮ���ƶ��ɣ����е�SO3��ת��Ϊ���ᣬ����445g����������ˮ���4.00L ���ᣬ����������ʵ���Ũ��Ϊ______mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѭ��������������̼��������Ŀǰ���ܹ�ע�Ŀ��⣬�����̼����Ļ�������ۺ����ó�Ϊ�о����ȵ㡣��ش��������⣺
��1��������ʵ�У����������Ƚ�̼Ԫ�غ���Ԫ�طǽ�����ǿ������______����ѡ����ĸ����
A��![]() ��Ư���Զ�
��Ư���Զ�![]() û��
û��
B������![]() ����
����![]() ��Ӧ����
��Ӧ����![]()
C��![]() ��ʹ����
��ʹ����![]() ��Һ��ɫ��
��Һ��ɫ��![]() ����
����
D��![]() ��Һ�Լ��Զ�
��Һ�Լ��Զ�![]() ��Һ������
��Һ������
��2����ͼ��ͨ����ѭ��������Դ���ۺ����ú���Ⱦ�����ķ�Ӧϵͳԭ����

ϵͳ�������������Ȼ�ѧ����ʽΪ_________������ϵͳ�Ƶõ�����H2�����������ٵ���________��
��3����10 L�����ܱ������г���2 mol CO��1 mol ![]() ��������Ӧ2CO(g)��SO2 (g)
��������Ӧ2CO(g)��SO2 (g)![]() S(g)��2CO2 (g)��CO��CO2��ƽ������������������¶ȣ�T���Ĺ�ϵ��ͼ��ʾ��
S(g)��2CO2 (g)��CO��CO2��ƽ������������������¶ȣ�T���Ĺ�ϵ��ͼ��ʾ��
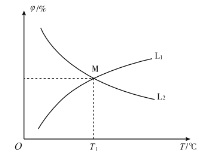
��ͼ���ܱ�ʾCO��ƽ������������¶ȹ�ϵ������Ϊ______������L1������L2������
��T1 ��ʱ��![]() ��ƽ��ת������1��_______����Ӧ��ƽ�ⳣ��
��ƽ��ת������1��_______����Ӧ��ƽ�ⳣ��![]() _________��
_________��
��ֻ�ı��������������ܼӿ�÷�Ӧ���ʣ���������CO��ƽ��ת���ʵ���_____����ѡ����ĸ����
A������ѹǿ B������һ����![]()
C�� ����һ����![]() D�������ʵ�����
D�������ʵ�����
������ʼ�¶�Ϊ![]() ���10 L���������г���2 mol CO��1 mol
���10 L���������г���2 mol CO��1 mol ![]() ���ظ�ʵ�飬�÷�Ӧ��ƽ�ⳣ��
���ظ�ʵ�飬�÷�Ӧ��ƽ�ⳣ��![]() _____
_____![]() ��������������������������������Ϊ_____��
��������������������������������Ϊ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ�����й�ͭ�����ᡢ���ữѧ���ʵ�ʵ�飬ʵ�������ͼ��ʾ��
ʵ��1 | ʵ��2 |
|
|
�١�������Һ����ɫ���Թܿ��к���ɫ������� | ������Һ����ɫ���Թܿ��к���ɫ������� |
����˵����ȷ����
A. ϡ����һ������ԭΪNO2
B. ʵ��1-������Һ���ڣ�c(Cu2+) + c(H+) ��c(NO3��) + c(OH��)
C. ������ʵ��ó����ۣ������£�Cu�ȿ���ϡ���ᷴӦ��Ҳ����ϡ���ᷴӦ
D. ʵ��1-�ۡ�ʵ��2-���з�Ӧ�����ӷ���ʽ��3Cu��2NO3-��8H+ =3Cu2+��2NO����4H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����![]() ��
��![]() �ĵ��Ӳ�ṹ��ͬ,��2��
�ĵ��Ӳ�ṹ��ͬ,��2��![]() ԭ����3��
ԭ����3��![]() ԭ�ӵĵ����������,������˵����ȷ����
ԭ�ӵĵ����������,������˵����ȷ����
A. ![]() Ϊ��Ԫ��
Ϊ��Ԫ��
B. ![]() Ԫ��ԭ�ӵ���Χ�����Ų�ʽΪ
Ԫ��ԭ�ӵ���Χ�����Ų�ʽΪ![]()
C. ![]() Ԫ��ԭ�ӵĺ�������Ų�ʽΪ
Ԫ��ԭ�ӵĺ�������Ų�ʽΪ![]()
D. ![]() ��
��![]() ����Ԫ�����ڱ���
����Ԫ�����ڱ���![]() ����Ԫ��
����Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ϊ�١����Ԫ�أ���Ԫ�����ڱ��е�λ�����£�
���� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0�� |
1 | �� | �� | ||||||
2 | �� | �� | �� | �� | ||||
3 | �� | �� | �� | �� |
�Իش��������⣺
��1��д��Ԫ�آ۵�����__��
��2���ٺܺ͢�Ԫ���γɵĻ�����Ļ�ѧʽΪ__���õ���ʽ��ʾ���γɹ���Ϊ__��
��3���ߺ͢��Ԫ�ص�����������ˮ����ļ����ǣ�__��__
��4���١��ݡ��ߺ�Ԫ���γɵ�һ�ֻ�����ĵ���ʽ��__���ڸû������мȺ���__�����ֺ���__����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2���ۺ����ö��ڼ����������塢������Դ��ȱ������Ҫ�����塣
����CO2�������ȶ��������ʽΪ___��
���ྦྷCu��Ψһ��ʵ��֤ʵ�ܸ�Ч��CO2��ԭΪ����(��CH4 ��C2H4)�Ľ��������װ�÷ֱ��ԶྦྷCu�Ͳ�Ϊ�缫���ϣ��������ӽ���Ĥ�ָ������������ң����������ҵ�KHCO3��Һ��Ũ��(Լ0.1 mol/L����)�������ֲ��䡣����ij�����ڳ���ͨ��CO2���¶ȿ�����10�����ҡ�
(1)����ͨ��CO2��ԭ����______��
(2)�о������������Ķ������ؾ�����C2H4��ѡ���Ժʹ����ԡ�
��֪��ѡ����=Ŀ����������ԭ����/ԭ���ܵ�ת����
�ڱ�ʵ�������£�����C2H4�ĵ缫��ӦΪ______��
(3)��ʵ�������£���CO2ת��Ϊ����ת����Ϊ10%������C2H4��ѡ����Ϊ12%�����ռ���12 mol C2H4����ͨ���CO2Ϊ______mol��
����CO2��CH4�����������Ƶúϳ�����CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ��H
2CO(g)+2H2(g) ��H
(1)��֪����Ӧ1��CH4(g) �TC(s)+2H2(g) ��H1=+75kJmol��1
��Ӧ2��H2(g) + CO2(g)![]() H2O(g)+CO(g) ��H2=+35kJmol��1
H2O(g)+CO(g) ��H2=+35kJmol��1
��Ӧ3��2CO(g) �TC(s)+ CO2(g) ��H3=��172kJmol��1
��ô�������Ӧ�ġ�H=___kJmol��1�����¶Ⱥ�ѹǿ�Ƕ����������CO2ƽ��ת���ʵ�������____��
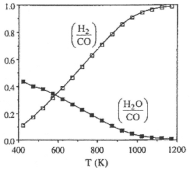
(2)��ͼ��ʾ��ϵ��c(H2)/c(CO)��c(H2O)/c(CO)�ı仯����������1200K����c(H2)/c(CO)С��1��ԭ��___�����������¶ȵ�����c(H2)/c(CO)�����ԭ��____��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com