
依据事实,写出下列反应的热化学方程式.
(1)已知拆开1mol H﹣H键,1mol N﹣H键,1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为: .
(2)以甲烷为原料制取氢气是工业上常用的制氢方法.
已知:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ•mol﹣1
CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+247.4kJ•mol﹣1
请写出CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式 .
考点: 用盖斯定律进行有关反应热的计算;有关反应热的计算.
分析: (1)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;
(2)利用盖斯定律解答,从待求反应出发分析反应物生成物在所给反应中的位置,通过相互加减可得.
解答: 解:(1)在反应N2+3H2⇌2NH3中,断裂3molH﹣H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N﹣H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ﹣2254kJ=92kJ,
故答案为:N2(g)+3H2(g) 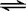 2NH3(g)△H=﹣92kJ•mol﹣1;
2NH3(g)△H=﹣92kJ•mol﹣1;
(2)①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=206.2kmol﹣1
②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=247.4kJmol﹣1
由盖斯定律,①×2﹣②得:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=165.0kmol﹣1,
故答案为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=165.0kmol﹣1.
点评: 有关盖斯定律的习题,首先要根据所求的反应分析,分析以下几点:
1、所求反应中的反应物在哪个反应了?是反应物还是生成物?
2、所给反应中哪些物质是所求反应中没有的?
3、如何才能去掉无用的?然后,通过相互加减,去掉无关物质.
将所对应的△H代入上述化学方程式的加减中就可以了.


科目:高中化学 来源: 题型:
同温同压下,已知下列各反应为放热反应,下列各热化学方程式中反应热最小的是()
A. 2A(l)+B(l)=2C(g)△H1 B. 2A(g)+B(g)=2C(g)△H2
C. 2A(g)+B(g)=2C(l)△H3 D. 2A(l)+B(l)=2C(l)△H4
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下按如图安装好实验装置,在锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液漏斗加入40mL 2.5mol•L﹣1的硫酸,将产生的H2收集在一个注射器中,用时10s时恰好收集到气体的体积为50mL(若折合成0℃、101kPa条件下的H2体积为44.8mL),在该温度下,下列说法不正确的是()
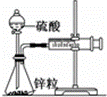
A. 用锌粒表示10 s内该反应的速率为0.013 g•s﹣1
B. 忽略锥形瓶溶液体积的变化,用H+来表示10 s该反应的速率0.01 mol•(L•s)﹣1
C. 忽略锥形瓶内溶液体积的变化,用Zn2+来表示10 s内反应的速率0.01 mol•(L•s)﹣1
D. 用H2表示10 s内该反应的速率为0.004 mol•(L•s)﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中,反应mA(g)+nB(g)⇌pC(g),达到平时,测得c(A)为0.5mol•L﹣1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3mol•L﹣1.则下列判断正确的是()
A. 化学计量数:m+n>p B. 平衡向正反应方向移动了
C. 物质B的转化率减小了 D. 物质C的质量分数增加了
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应中的能量变化,表述正确的是()
A. 放热反应中,反应物的总能量大于生成物的总能量
B. 断开化学键的过程会放出能量
C. 加热才能发生的反应一定是吸热反应
D. 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
查看答案和解析>>
科目:高中化学 来源: 题型:
在2A+B⇌3C+4D反应中,表示该反应速率最快的是()
A. υ(A)=0.5 mol/(L•s) B. υ(B)=1 mol/(L•s)
C. υ(C)=0.8 mol/(L•s) D. υ(D)=0.3 mol/(L•s)
查看答案和解析>>
科目:高中化学 来源: 题型:
我们饮用的水是由源水净化所得。已知,明矾能将水中的悬浮物凝聚而沉淀,氯气可杀菌。家庭饮用水的净化过程正确的是 ( )。
A.源水→过滤→加氯气→加明矾→沉淀→净水
B.源水→加氯气→过滤→加明矾→沉淀→净水
C.源水→加明矾→加氯气→过滤→沉淀→净水
D.源水→加明矾→沉淀→过滤→加氯气→净水
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是()
A. 10ml质量分数为98%的H2SO4,用10ml水稀释后,H2SO4的质量分数大于49%
B. 配制0.1mol/L的Na2CO3溶液480ml,需用500ml容量瓶
C. 在标况下,将22.4L氨气溶于1L水中,得到1mol/L的氨水
D. 向2等份不饱和的烧碱溶液中分别加入一定量的Na2O2和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O的物质的量之比等于1:1(保持温度不变)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com