C
分析:A、根据PH值和氢氧化钡中氢氧根浓度之间的关系来分析;
B、根据反应中转移的电子的量以及元素化合价的变化情况来回答;
C、根据乙烯和丁烯的最简式都是CH
2的特点来分析;
D、根据标准状况下甲醇为液态来分析.
解答:A、PH=13也就是意味着
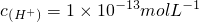
,则
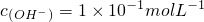
,
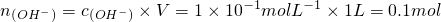
,所以

,故A错误;
B、发生的化学反应方程式为Cl
2+2NaOH=NaCl+NaClO+H
2O(该反应为歧化反应),

,那么转移电子的数目应该为0.1N
A,故B错误;
C、乙烯和丁烯的最简式都是CH
2,则
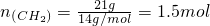
,所以n
(C)=1.5mol,N
(C)=1.5N
A,故C正确;
D、标准状况下,甲醇为液态,那么甲醇的物质的量就不是1mol,则所含有的氧原子个数也不为N
A,故D错误.
故选C.
点评:以阿伏伽德罗常数为载体考察如下知识点:①考查22.4L/mol的正确使用;②考查在氧化还原反应中得失电子数的计算;③正确表示一定物质的量的某物质微粒所含某种微粒的个数;④考查在标准状况下一定体积的气体分子所含的分子数和原子数.

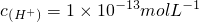 ,则
,则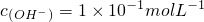 ,
,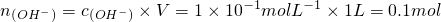 ,所以
,所以 ,故A错误;
,故A错误; ,那么转移电子的数目应该为0.1NA,故B错误;
,那么转移电子的数目应该为0.1NA,故B错误;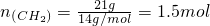 ,所以n(C)=1.5mol,N(C)=1.5NA,故C正确;
,所以n(C)=1.5mol,N(C)=1.5NA,故C正确;
