
| 元素 | T | X | Y | Z |
| 性质 结构 信息 | 人体内含量最多的元素,且其单质是常见的助燃剂. | 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼. | 单质质软、银白色固体、导电性强. 单质在空气中燃烧发出黄色的火焰. | 第三周期元素的简单离子中半径最小 |
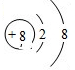 ;写出元素X的气态氢化物的电子式
;写出元素X的气态氢化物的电子式 ;离子半径比较:Y离子>Z离子(填“>”或“<”).
;离子半径比较:Y离子>Z离子(填“>”或“<”).分析 T是人体内含量最多的元素,且其单质是常见的助燃剂,所以T是O元素;X单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼,所以X是N元素;Y单质质软、银白色固体、导电性强,单质在空气中燃烧发出黄色的火焰,则Y是Na元素;第三周期元素的简单离子的电子层数相同,其离子半径随着原子序数的增大而减小,已知Z是第三周期元素的简单离子中半径最小,所以Z是Al元素,据此进行解答.
解答 解:T是人体内含量最多的元素,且其单质是常见的助燃剂,所以T是O元素;X单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼,所以X是N元素;Y单质质软、银白色固体、导电性强,单质在空气中燃烧发出黄色的火焰,则Y是Na元素;第三周期元素的简单离子的电子层数相同,其离子半径随着原子序数的增大而减小,已知Z是第三周期元素的简单离子中半径最小,所以Z是Al元素,
(1)T是氧元素,氧原子的核电荷数=8,氧离子的核外电子总数为10,其离子结构示意图为: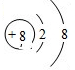 ,X是氮元素,它的气态氢化物为氨气,氨气属于共价化合物,其电子式为:
,X是氮元素,它的气态氢化物为氨气,氨气属于共价化合物,其电子式为: ;第三周期元素的简单离子的电子层数相同,其离子半径随着原子序数的增大而减小,所以离子半径:Na+>Al3+;
;第三周期元素的简单离子的电子层数相同,其离子半径随着原子序数的增大而减小,所以离子半径:Na+>Al3+;
故答案为: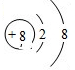 ;
; ;>;
;>;
(2)Z为Al,Y的最高价氧化物对应的水化物为氢氧化钠,Al与NaOH溶液反应生成氢氧化钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)Z为Al元素,其最高价氧化物对应的水化物为氢氧化铝,氢氧化铝为两性氢氧化物,存在酸式电离和碱式电离,其电离方程式为:AlO2-+H2O+H+?Al(OH)3?Al3++3OH-,
故答案为:AlO2-+H2O+H+?Al(OH)3?Al3++3OH-;
(4)T为O,O元素的非金属性小于F;
a.常温下氟气的颜色比T单质的颜色深:气体的颜色与非金属性强弱没有必然关系,故a错误;
b.氟气与T的氢化物剧烈反应,产生T的单质:证明非金属性F大于O元素,故b正确;
c.氟与O形成的化合物中O元素呈正价态,说明F原子吸引电子能力大于O,则非金属性F大于O,故c错误;
d.比较两元素的单质与氢气化合时得电子的数目:得失电子数目与非金属性、金属性没有必然关系,故d错误;
故答案为:F;bc.
点评 本题考查了位置、结构与性质关系的应用,题目难度中等,试题侧重学生的分析能力的考查,正确推断各元素名称为解答关键,注意明确原子结构与元素周期表、元素周期律的关系.


科目:高中化学 来源: 题型:选择题
| A. | 群众向高处转移 | |
| B. | 用沾NaOH溶液的湿毛巾捂住口鼻 | |
| C. | 用高压水枪向空中喷洒含碱性物质的水溶液可解毒 | |
| D. | 用沾Na2CO3溶液的湿毛巾捂住口鼻 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ①② | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
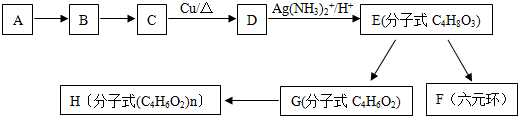
 或
或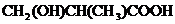 或
或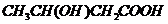 或
或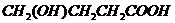
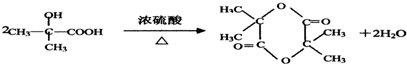

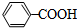
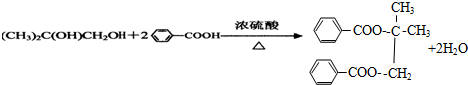 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
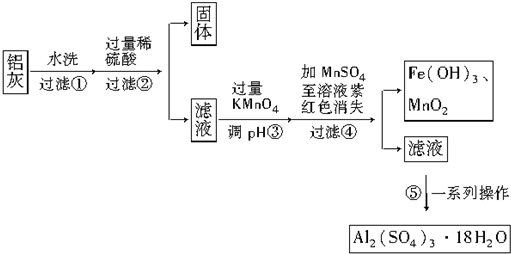
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com