
| A. | 反应能否自发进行与温度无关 | |
| B. | 能自发进行的化学反应,一定是△H>0、△S>0 | |
| C. | 放热反应一定都是自发的 | |
| D. | 电解池的反应不属于自发过程 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.010mol•L-1•s-1 | B. | v(O2)=0.0010mol•L-1•s-1 | ||
| C. | v(NO)=0.0010mol•L-1•s-1 | D. | v(H2O)=0.045mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在合成氨的反应中,增大压强有利于氨的合成 | |
| B. | H2、I2、HI三者的平衡混合气,加压(缩小容器体积)后颜色变深 | |
| C. | 新制的氯水在光照下颜色变浅 | |
| D. | 氯气可以用排饱和食盐水的方法收集(Cl2+H2O═HCl+HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镀锌铁皮的镀层损坏后,铁更容易腐蚀 | |
| B. | 镀锡铁皮的镀层损坏后,铁更容易腐蚀 | |
| C. | 金属腐蚀就是金属原子失去电子被还原的过程 | |
| D. | 钢铁吸氧腐蚀时,负极反应式为:2H2O+O2+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
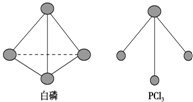 白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10.
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com