
稀土元素是周期表中Ⅲ B族钪、钇和镧系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3。其中钇(Y)元素是激光和超导的重要材料。我国蕴藏着丰富的钇矿石( Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下: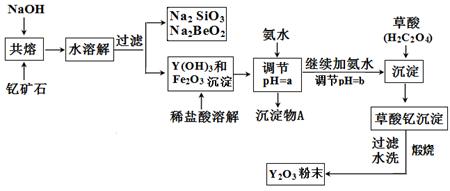
已知:I.有关金属离子形成氢氧化物沉淀时的pH如下表:
| | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
(1)Y2O3·FeO·2BeO·2SiO2 (2分)
(2)①b(2分),过滤 (1分) ②BeO22-+4H+=Be2++2H2O(2分)
(3)3.7<a<6.0 (2分) Y3++3NH3·H2O=Y(OH)3↓+3NH4+(2分)
当溶液中c(Fe3+)<10-5mol/L时,则可判定Fe3+完全沉淀(1分)
解析试题分析:(1)依据元素化合价和原子守恒书写元素的氧化物组成,所以钇矿石(Y2 FeBe2Si2O10)的组成用氧化物的形式可表示为Y2O3·FeO·2BeO·2SiO2
(2)①周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似,Be(OH)2与Al(OH)3相似,具有两性,加过量的盐酸,硅酸钠反应生成硅酸沉淀,Na2BeO2的反应生成氯化铍溶液,再加入过量氨水沉淀铍离子,故答案为:b;分离难溶的固体与溶液的操作为过滤。
②Na2BeO2与足量盐酸生成BeCl2、NaCl和H2O,所以离子方程式为:BeO22-+4H+=Be2++2H2O
(3)三价铁离子开始沉淀到沉淀完全的PH范围为:2.7-3.7;钇离子开始沉淀和沉淀完全的PH为:6.0-8.2,所以使Fe3+沉淀完全,须用氨水调节pH=a的范围为:3.7<a<6.0;继续加氨水调节pH=b发生反应的离子方程式为:Y3++3NH3?H2O=Y(OH)3↓+3NH4+;当离子浓度<10-5mol/L时,则可说明离子已沉淀完全,所以当溶液中c(Fe3+)<10-5mol/L时,则可判定Fe3+完全沉淀。
考点:本题考查物质组成的表达式、基本操作和试剂的选择、离子方程式的书写、物质分离试验方法设计,离子分离和离子检验的实验操作。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
为了回收利用钢铁生产过程中产生的SO2,工业上采用软锰矿(主要成分MnO2)脱硫同时制取硫酸锰技术,其流程示意图如下: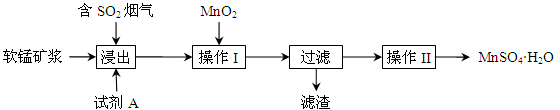
已知:浸出液的pH接近4,其中的金属离子主要是Mn2+,还含有少量的Fe2+。完成下列填空。
(1)写出浸出过程中主要反应的化学方程式: 。
(2)浸出过程的副反应之一是部分SO2被氧化为硫酸,致使浸出液的pH下降,这将 (“有利”、“不利”)于软锰矿浆继续吸收SO2。欲消除生成的硫酸,试剂A最好是 。
a.MnCO3 b.MnO2 c.CaO d.CaCO3
(3)操作I的目的是除去浸出液中的Fe2+,MnO2在氧化Fe2+的同时还 ,使Fe3+沉淀。检验过滤后溶液中是否含有Fe3+的操作是 。
(4)已知大于27℃时,MnSO4·H2O溶解度随温度上升而明显下降,则操作II的过程为: 、 、洗涤、干燥。工业上为了充分利用锰元素,在流程中 可循环使用。
(5)通过煅烧MnSO4·H2O 可制得生产软磁铁氧体材料的MnxO4,如图是煅烧MnSO4·H2O时温度与剩余固体质量变化曲线。该曲线中A段所表示物质的化学式为 ;MnxO4中x= 。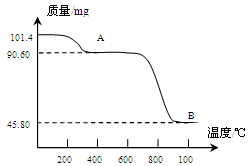
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
卤块的主要成分是MgCl2,此外还含 Fe3+、Fe2+和Mn2+等离子。以卤块为原料可制得轻质氧化镁,工艺流程如下图: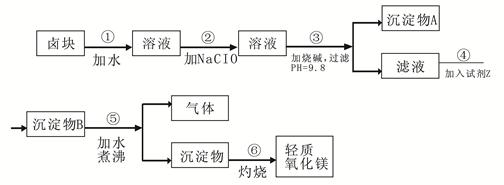
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1表2提供的资料,填写空白:
表1 生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 试剂 | 价格(元/吨) |
| 漂液(含NaClO,25.2%) | 450 |
| 双氧水(含H2O2 ,30%) | 2400 |
| 烧碱(含98% NaOH) | 2100 |
| 纯碱(含99.5% Na2CO3) | 600 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高铁酸钾(K2FeO4)是新型多功能水处理剂,碱性条件下性质稳定,其生产过程如下: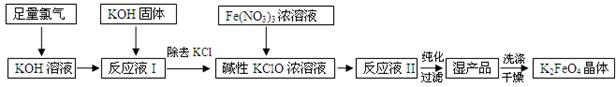
请回答下列问题
(1)氯碱工业制Cl2的化学反应方程式 ;
(2)生成“反应液Ⅱ”的离子方程式是 ;(3)使用碱性KClO的原因是 ;
(4)从“反应液II”中分离出K2FeO4后 ,副产品是KCl和 (填化学式),该混合物可用 方法分离提纯(填字母序号);
| A.过滤 | B.分液 | C.蒸馏 | D.重结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中做辅助剂,在化学工业和制药工业中也可做氧化剂,应用领域十分广泛。实验室中红矾钠可用一种铬铁矿(主要成分:FeO·Cr2O3,还含有少量的Al2O3)通过以下过程来制取。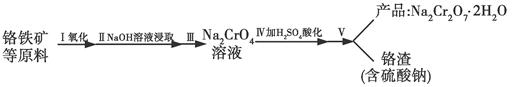
回答下列问题:
(1)步骤Ⅰ中反应化学方程式为4FeO2·Cr2O3(s)+8Na2CO3(s)+7O2(g)=8Na2CrO4(s)+2Fe2O3(s)+8CO2(g)。
①在实验室,步骤Ⅰ应在________(填“陶瓷”或“铁”)坩埚中完成。
②在常温下该反应速率极慢,下列措施中能使反应速率增大的是________(填字母)。
A.将原料粉碎 B.增加纯碱的用量 C.升高温度
(2)步骤Ⅱ中NaOH的作用是________________________(用化学反应方程式表示)。
(3)步骤Ⅳ中发生反应的离子方程式为________;反应完成的标志是________。
(4)利用下面的复分解反应,将红矾钠与KCl固体按1?2物质的量之比混合溶于水后经适当操作可得到K2Cr2O7晶体:Na2Cr2O7+2KCl=K2Cr2O7+2NaCl(已知:温度对氯化钠的溶解度影响很小,对重铬酸钾的溶解度影响较大)
基本实验步骤为①溶解;②________;③________;④冷却,结晶,再过滤得K2Cr2O7晶体。其中③应在________(填“高温”或“低温”)条件下进行。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌,亚氯酸钠受热易分解。以氯酸钠(NaClO3)等为原料制备亚氯酸钠的工艺流程如下: 
(1)提高“反应1”反应速率的措施有 、 。(回答两点即可)
(2)“反应1” 的离子方程式是 。
(3)“反应2”的氧化剂是 ,该反应的化学方程式为 。
(4)采取“减压蒸发”而不用“常压蒸发”,原因是 。
(5)某学习小组用碘量法测定粗产品中亚氯酸钠的含量,实验如下:
A.准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250mL待测溶液。(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-)
B.移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用C mol·L-1 Na2S2O3标准液滴定至终点,重复2次,测得平均值为V mL 。
(已知:I2+2S2O32-=2I-+S4O62-)
①达到滴定终点时的现象为 。
②该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
海洋是一个丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用。
(1) 海水中盐的开发利用:
Ⅰ.海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、蒸发池和_______池。
II.目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用____________________________________________。(写一点即可)
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如下图所示。请回答后面的问题: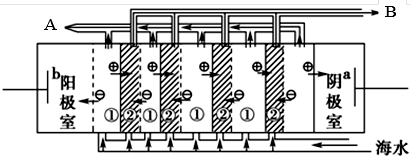
Ⅰ.海水不能直接通入到该装置中,理由是_____________________________________________。
Ⅱ. B口排出的是________(填“淡水”或“浓水”)。
(3)用苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如下:
Ⅰ.若吸收塔中的溶液含BrO3-,则吸收塔中反应的离子方程式为_____________
_________________________________________。
Ⅱ.通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液?_____________________________________________________________________。
Ⅲ.向蒸馏塔中通入水蒸气加热,控制温度在900C左右进行蒸馏的原因是___________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氧化铜矿中含有主要杂质为Fe2+和Al3+等,用其生产CuSO4·5H2O主要工艺流程如下图。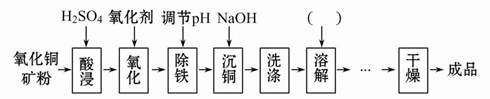
(1)图中加入氧化剂的目的是 ,结合下表回答除铁步骤的最佳pH范围为 。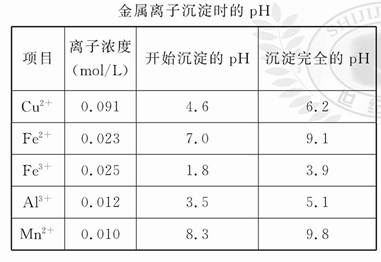
(2)氧化剂若选用KMnO4,会降低产品的纯度,其原因是 ,实际生产中NaClO作为最佳氧化剂,发生反应的离子方程式为 。
(3)请在下图中完善所缺步骤及所添加试剂的化学式。可供选择的操作有:萃取、蒸发浓缩、过滤、洗涤、降温结晶、蒸馏、分液。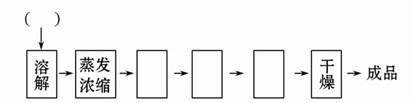
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com