
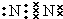 ,雷电作用能进行氮的固定,写出反应方程式N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO.
,雷电作用能进行氮的固定,写出反应方程式N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO.分析 (1)氮原子最外层5个电子,氮气中两个氮原子形成3对共用电子对;空气中的氮气与氧气在雷电的作用下发生反应生成一氧化氮;
(2)蛋白质是由氨基酸缩合而成的含氮的高分子化合物,蛋白质水解生成多肽化合物,多肽化合物水解最终产物为氨基酸;
(3)NH4+在硝化细菌的催化作用下被空气中的氧气氧化为硝酸根离子,依据得失电子守恒写出化学方程式;
(4)镁铝合金与足量稀硝酸发生氧化还原反应,转化成硝酸镁和硝酸铝,部分硝酸得到电子被还原为NO,向反应后的溶液中加入过量的氨水,镁、铝离子完全反应生成氢氧化镁、氢氧化铝沉淀,依据质量守恒和氧化还原反应中电子得失守恒计算解答.
解答 解:(1)氮气中两个氮原子形成3对共用电子对,电子式为: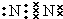 ;氮气与氧气在雷电的作用下发生反应生成一氧化氮,方程式为:N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO;
;氮气与氧气在雷电的作用下发生反应生成一氧化氮,方程式为:N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO;
故答案为: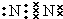 ;N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO;
;N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO;
(2)蛋白质是由氨基酸缩合而成的含氮的高分子化合物,属于食物蕴含的营养物质中,含氮的高分子化合物是蛋白质;蛋白质水解生成多肽化合物,多肽化合物水解最终产物为氨基酸,所以蛋白质水解的最终产物为氨基酸,
故答案为:蛋白质;氨基酸;
(3)NH4+在硝化细菌的催化作用下被空气中的氧气氧化的离子方程式为:NH4++2O2$\frac{\underline{\;硝化细菌\;}}{\;}$ NO3-+H2O+2H+,
故答案为:NH4++2O2 $\frac{\underline{\;硝化细菌\;}}{\;}$NO3-+H2O+2H+;
(4)设合金中镁的物质的量为xmol,铝的物质的量为ymol,反应中镁失去电子变成二价镁离子,铝失去电子变成铝离子,硝酸中氮原子有+5价将为NO中的+2价,依据氧化还原反应中得失电子相等的规律则:
2x+3y=$\frac{11.2L}{22.4L/mol}$×(5-2);
向溶液中加入过量氨水,充分反应后过滤,沉淀质量为40.8g为氢氧化镁和氢氧化铝沉淀质量,
依据元素守恒计算得到:58x+78y=40.8
解得:x=0.3mol
y=0.3mol
合金的质量=m(Mg)+m(Al)=0.3mol×24g/mol+0.3mol×27g/mol=15.3g
故答案为:15.3.
点评 本题考查了氮及其化合物的性质,题目涉及到电子式的书写、化学方程式的书写、离子方程式的书写、硝酸的相关计算,综合性强,难度中等,解题的关键在于把握反应的过程,抓住氧化还原反应中得失电子守恒、原子个数守恒的规律.


科目:高中化学 来源: 题型:选择题
| A. | 铝片与稀H2SO4反应 | B. | 灼热的炭与H2O反应 | ||
| C. | Ba(OH)2•8H2O与NH4Cl反应 | D. | 甲烷在O2中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为CH2=CH2 | B. | CH4分子的比例模型: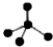 | ||
| C. | 8个中子的碳原子的符号:12C | D. | 氯化镁的电子式: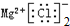 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业酒精中含有乙醇和甲醇 | B. | 在煤炭和石油中,苯的含量都较高 | ||
| C. | 许多水果中含有酯类化合物 | D. | 天然油脂中含有高级脂肪酸甘油酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| D. | 用Pt电极电解饱和氯化镁溶液:2Cl-+2H2$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | 电离常数(298K) |
| 硼酸 | K=5.7×10-10 |
| 碳酸 | K1=4.4×10-7 K2=4.7×10-11 |
| 醋酸 | K=1.75×10-5 |
| A. | 将一滴碳酸钠溶液滴入一硼酸溶液中一定能观察到有气泡产生 | |
| B. | 将一滴醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生 | |
| C. | 向0.2 mol•L-1 NaHCO3溶液中加入等体积的0.1 mol•L-1NaOH溶液:c(H2CO3)+c(H+)+c(HCO3-)=c(OH-)+c(CO32-) | |
| D. | 等物质的量浓度的碳酸溶液和醋酸溶液比较,pH:前者>后者 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com