
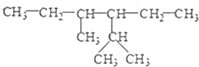
 µÄĻµĶ³ĆüĆūĪŖ£ŗ2£¬4-¶ž¼×»ł-3-ŅŅ»łŅŅĶé
µÄĻµĶ³ĆüĆūĪŖ£ŗ2£¬4-¶ž¼×»ł-3-ŅŅ»łŅŅĶé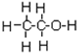 £¬ŅŅĻ©µÄµē×ÓŹ½ĪŖ
£¬ŅŅĻ©µÄµē×ÓŹ½ĪŖ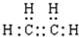
 £¼
£¼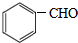
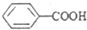 £¾CH3COOH£ØĢįŹ¾£ŗĄą±Č·ÓÓė“¼µÄĖįŠŌ£©
£¾CH3COOH£ØĢįŹ¾£ŗĄą±Č·ÓÓė“¼µÄĖįŠŌ£©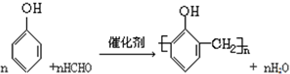
 £®
£® ·ÖĪö £Ø1£©¢Ł µÄ×ī³¤Ģ¼Į“ĪŖ6£¬·Ö±šŌŚ2”¢4ŗÅĢ¼ÉĻŗ¬ÓŠ1øö¼×»ł£¬ŌŚ3ŗÅĢ¼ÉĻŗ¬ÓŠ1øöŅŅ»ł£»
µÄ×ī³¤Ģ¼Į“ĪŖ6£¬·Ö±šŌŚ2”¢4ŗÅĢ¼ÉĻŗ¬ÓŠ1øö¼×»ł£¬ŌŚ3ŗÅĢ¼ÉĻŗ¬ÓŠ1øöŅŅ»ł£»
¢Ś¼×»łĪŖ¼×ĶéČ„µōŅ»øöHŌ×ÓŠĪ³ÉµÄŌ×ÓĶÅ£¬ŅŅ“¼ÖŠŗ¬ÓŠōĒ»ł£¬ŅŅĻ©ÖŠ“ęŌŚĢ¼Ģ¼Ė«¼ü£»
¢Ū¼×Č©µÄĖ®ČÜŅŗ³ĘĪŖø£¶ūĀķĮÖ£¬ŅĄ¾ŻŅŅĖį·Ö×ÓŹ½ŹéŠ“Ķ¬·ÖŅģ¹¹Ģ壬ӊ¼øÖÖ»Æѧ»·¾³²»Ķ¬µÄH¾ĶÓŠ¼øÖַ壻
£Ø2£©¢ŁĢ¼Ō×ÓŹżŌ½¶ą£¬ōĒ»łŹżŌ½¶ą£¬·ŠµćŌ½øߣ»
¢ŚČ©ÓėĖ®ŅŌČĪŅā±Č»ģČÜ£¬ĶéĢžÄŃČÜÓŚĖ®£¬¼×»ł½µµĶČ©»łµÄČܽā¶Č£»
¢Ū±½¼×ĖįÖŠōČ»łÉĻµÄĒāĄė×ÓµēĄėŗóŠĪ³ÉµÄøŗĄė×ÓŗĶ±½»·µÄ¹²éī½į¹¹·¢Éś¹²éī£»
£Ø3£©¢Ł·ÓČ©Ź÷Ö¬ŹĒÓɱ½·ÓŗĶ¼×Č©ŌŚ“߻ƼĮĢõ¼žĻĀĖõ¾Ū¶ų³É£¬·“Ó¦»śĄķŹĒ±½·ÓōĒ»łĮŚĪ»ÉĻµÄĮ½øöĒāŌ×Ó±Č½Ļ»īĘĆ£¬Óė¼×Č©Č©»łÉĻµÄŃõŌ×Ó½įŗĻĪŖĖ®·Ö×Ó£¬ĘäÓą²æ·ÖĮ¬½ÓĘšĄ“³ÉĪŖøß·Ö×Ó»ÆŗĻĪļ£»
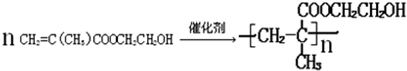
¢Ś¼Ó¾Ū·“Ó¦ŌĄķŹĒ¶ĻæŖĢ¼Ģ¼Ė«¼ü£¬ŠĪ³Éøß¾ŪĪļ£¬¾Ż“ĖŹéŠ“¼“æÉ£®
½ā“š ½ā£ŗ£Ø1£©¢Ł µÄ×ī³¤Ģ¼Į“ĪŖ6£¬·Ö±šŌŚ2”¢4ŗÅĢ¼ÉĻŗ¬ÓŠ1øö¼×»ł£¬ŌŚ3ŗÅĢ¼ÉĻŗ¬ÓŠ1øöŅŅ»ł£¬ÕżČ·ĆüĆūĪŖ£ŗ2£¬4¶ž¼×»ł-3-ŅŅ»ł¼ŗĶ飬¹Ź“š°øĪŖ£ŗ2£¬4-¶ž¼×»ł-3-ŅŅ»ł¼ŗĶ飻
µÄ×ī³¤Ģ¼Į“ĪŖ6£¬·Ö±šŌŚ2”¢4ŗÅĢ¼ÉĻŗ¬ÓŠ1øö¼×»ł£¬ŌŚ3ŗÅĢ¼ÉĻŗ¬ÓŠ1øöŅŅ»ł£¬ÕżČ·ĆüĆūĪŖ£ŗ2£¬4¶ž¼×»ł-3-ŅŅ»ł¼ŗĶ飬¹Ź“š°øĪŖ£ŗ2£¬4-¶ž¼×»ł-3-ŅŅ»ł¼ŗĶ飻
¢Ś¼×»łĪŖ¼×ĶéČ„µōŅ»øöHŌ×ÓŗóŹ£ÓąµÄŌ×ÓĶÅ£¬½į¹¹¼ņŹ½ĪŖ£ŗ-CH3£¬ŅŅ“¼ÖŠŗ¬ÓŠōĒ»ł£¬½į¹¹Ź½ĪŖ£ŗ £¬ŅŅĻ©ÖŠ“ęŌŚĢ¼Ģ¼Ė«¼ü£¬µē×ÓŹ½ĪŖ£ŗ
£¬ŅŅĻ©ÖŠ“ęŌŚĢ¼Ģ¼Ė«¼ü£¬µē×ÓŹ½ĪŖ£ŗ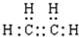 £¬¹Ź“š°øĪŖ£ŗ-CH3£»
£¬¹Ź“š°øĪŖ£ŗ-CH3£» £»
£»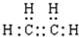 £»
£»
¢Ū¼×Č©µÄĖ®ČÜŅŗĖ׳Ęø£¶ūĀķĮÖ£¬¼×Ėį¼×õ„ÓėŅŅĖį»„ĪŖĶ¬·ÖŅģ¹¹Ģ壬½į¹¹¼ņŹ½ĪŖ£ŗHCOOCH3£¬¶Ō¶ž¼×»ł»·ŅŃĶéÖŠÓŠ3ÖÖ»Æѧ»·¾³²»Ķ¬µÄH£¬¹ŹŗĖ“Ź²ÕńĒāĘ×ÓŠ3×é·å£¬¹Ź“š°øĪŖ£ŗ¼×Č©£»HCOOCH3£»3£»
£Ø2£©¢ŁĢ¼Ō×ÓŹżŌ½¶ą£¬ōĒ»łŹżŌ½¶ą£¬·ŠµćŌ½øߣ¬±ūČż“¼ÖŠŗ¬ÓŠ3øöCŗĶ3øöōĒ»ł£¬ ÖŠŗ¬ÓŠ3øöCŗĶ2øöōĒ»ł£¬¹Ź±ūČż“¼µÄ·ŠµćøßÓŚ
ÖŠŗ¬ÓŠ3øöCŗĶ2øöōĒ»ł£¬¹Ź±ūČż“¼µÄ·ŠµćøßÓŚ £¬¹Ź“š°øĪŖ£ŗ£¼£»
£¬¹Ź“š°øĪŖ£ŗ£¼£»
¢ŚČ©ÓėĖ®ŅŌČĪŅā±Č»ģČÜ£¬ĶéĢžÄŃČÜÓŚĖ®£¬¼×»ł½µµĶČ©»łµÄČܽā¶Č£¬ĖłŅŌĖ®ČÜŠŌ£ŗ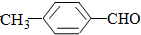 £¼
£¼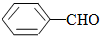 £¬¹Ź“š°øĪŖ£ŗ£¼£»””””
£¬¹Ź“š°øĪŖ£ŗ£¼£»””””
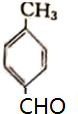
¢Ū±½¼×ĖįÖŠōČ»łÉĻµÄĒāĄė×ÓµēĄėŗóŠĪ³ÉµÄøŗĄė×ÓŗĶ±½»·µÄ¹²éī½į¹¹·¢Éś¹²éī£¬Ź¹±½¼×ĖįøłĄė×Ó±ČŅŅĖįøłĄė×ÓøüĪČ¶Ø£¬ĖłŅŌĖįŠŌ±½¼×ĖįĒ棬¹Ź“š°øĪŖ£ŗ£¾£»
£Ø3£©¢Ł±½·ÓōĒ»łĮŚĪ»ÉĻµÄĮ½øöĒāŌ×Ó±Č½Ļ»īĘĆ£¬Óė¼×Č©Č©»łÉĻµÄŃõŌ×Ó½įŗĻĪŖĖ®·Ö×Ó£¬ĘäÓą²æ·ÖĮ¬½ÓĘšĄ“³ÉĪŖøß·Ö×Ó»ÆŗĻĪļ--·ÓČ©Ź÷Ö¬£®·“Ó¦µÄ·½³ĢŹ½æÉŅŌ±ķŹ¾ĪŖ£ŗ £¬¹Ź“š°øĪŖ£ŗ
£¬¹Ź“š°øĪŖ£ŗ £»
£»
¢ŚCH2=C£ØCH3£©COOCH2CH2OHŌŚ“߻ƼĮ×÷ÓĆĻĀ·¢Éś¼Ó¾Ū·“Ó¦·½³ĢŹ½ĪŖ£ŗ £¬¹Ź“š°øĪŖ£ŗ
£¬¹Ź“š°øĪŖ£ŗ £®
£®
µćĘĄ ±¾ĢāÖ÷ŅŖæ¼²éµÄŹĒÓŠ»ś»ÆŗĻĪļµÄĆüĆūÓė½į¹¹¼ņŹ½µÄŹéŠ“”¢ÓŠ»śĪļČŪ·ŠµćŅŌ¼°ĖįŠŌĒæČõµÄ±Č½Ļ£¬ÓŠ»ś»Æѧ·“Ó¦·½³ĢŹ½µÄŹéŠ“µČ£¬×ŪŗĻŠŌ½ĻĒ棬ӊŅ»¶ØµÄÄŃ¶Č£®


 ²Ø²ØŠÜŹī¼Ł×÷Ņµ½Ī÷ČĖĆń³ö°ęÉēĻµĮŠ“š°ø
²Ø²ØŠÜŹī¼Ł×÷Ņµ½Ī÷ČĖĆń³ö°ęÉēĻµĮŠ“š°ø ѧ¶ųÓÅŹīĘŚĻĪ½ÓÄĻ¾©“óѧ³ö°ęÉēĻµĮŠ“š°ø
ѧ¶ųÓÅŹīĘŚĻĪ½ÓÄĻ¾©“óѧ³ö°ęÉēĻµĮŠ“š°ø Happy holiday»¶ĄÖ¼ŁĘŚŹī¼Ł×÷Ņµ¹ć¶«ČĖĆń³ö°ęÉēĻµĮŠ“š°ø
Happy holiday»¶ĄÖ¼ŁĘŚŹī¼Ł×÷Ņµ¹ć¶«ČĖĆń³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 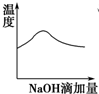 | B£® | 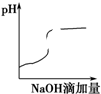 | C£® |  | D£® | 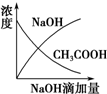 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĀČĖ® | B£® | ¶žŃõ»ÆĮņ | C£® | ĀČ»ÆÄĘČÜŅŗ | D£® | ĘÆ°×·ŪČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 0.1 | B£® | 0.2 | C£® | 0.4 | D£® | 0.8 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
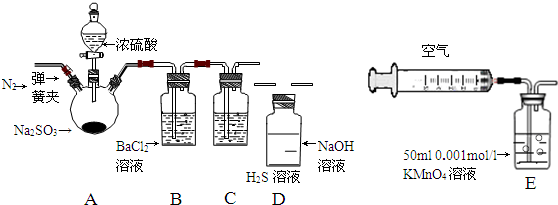
| ŹµŃé²½Öč | ŹµŃé²Ł×÷ | Ō¤ĘŚĻÖĻóÓė½įĀŪ |
| 1 | ȔɣĮæČÜŅŗÓŚŹŌ¹Ü£¬µĪČė¼øµĪ·ÓĢŖ | ČÜŅŗ±äŗģ |
| 2 | Č»ŗó¼ÓČė×ćĮæµÄBaCl2ČÜŅŗ | ČÜŅŗÖŠ²śÉś°×É«³Įµķ£¬×īŗóČōŗģÉ«ĶŹČ„£¬ŌņĖµĆ÷¢ŁÕżČ·£»ČōŗģÉ«²»ÄÜĶŹČ„£¬ŌņĖµĆ÷¢ŚÕżČ· |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğ½Ī÷Ź”ø߶žÉĻ10ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
æÕĘųÖŠCO2µÄŗ¬Įæ¼°ÓŠŠ§ĄūÓĆ£¬ŅŃ¾ŅżĘšø÷¹śµÄĘÕ±éÖŲŹÓ
¢ń£ŗÄæĒ°¹¤ŅµÉĻÓŠŅ»ÖÖ·½·ØŹĒÓĆCO2Ą“Éś²śČ¼ĮĻ¼×“¼£®ĪŖĢ½¾æ·“Ó¦ŌĄķ£¬ĻÖ½ųŠŠČēĻĀŹµŃ飬ŌŚĢå»żĪŖ1LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ£¬³äČė1mol CO2ŗĶ3mol H2£¬Ņ»¶ØĢõ¼žĻĀ·¢Éś·“Ó¦£ŗCO2(g)+3H2(g) 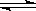 CH3OH(g)+H2O(g)”÷H=©49.0kJ/mol£»²āµĆCO2ŗĶCH3OH(g)µÄÅضČĖꏱ¼ä±ä»ÆČēĶ¼¼×ĖłŹ¾£®
CH3OH(g)+H2O(g)”÷H=©49.0kJ/mol£»²āµĆCO2ŗĶCH3OH(g)µÄÅضČĖꏱ¼ä±ä»ÆČēĶ¼¼×ĖłŹ¾£®
(1)Ē°3minÄŚ£¬Ę½¾ł·“Ó¦ĖŁĀŹv(H2)=_________ _____£®“ĖĪĀ¶ČĻĀøĆ·“Ó¦µÄĘ½ŗā³£ŹżĪŖ____________(±£ĮōĮ½Ī»Š”Źż)£®
(2)ĻĀĮŠ“ėŹ©ÖŠ£¬¼ČÄÜŹ¹·“Ó¦¼Óæģ£¬ÓÖÄÜŹ¹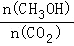 Ōö“óµÄŹĒ___________£®
Ōö“óµÄŹĒ___________£®
A£®ÉżøßĪĀ¶Č B£®³äČė¶čŠŌĘųĢå C£®½«H2O(g)“ÓĢåĻµÖŠ·ÖĄė D£®ŌŁ³äČė1mol H2
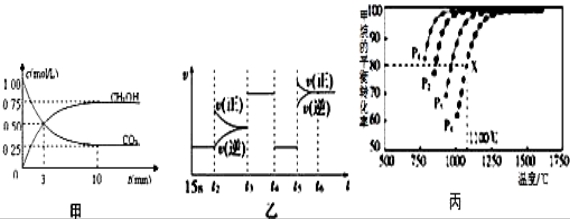
(3)Ķ¼ŅŅÖŠt5Ź±ŅżĘšĘ½ŗāŅĘ¶ÆµÄ Ģõ¼žŹĒ_____________£®(ĢīŠņŗÅ)
Ģõ¼žŹĒ_____________£®(ĢīŠņŗÅ)
A£®ÉżøßĪĀ¶Č B£®Ōö“ó·“Ó¦ĪļÅØ¶Č C£®Ź¹ÓĆ“ß»Æ¼Į D£®Ōö“óĢåĻµŃ¹Ēæ
(4)·“Ó¦“ļµ½Ę½ŗāŗó£¬ČōĻņ·“Ó¦ĢåĻµŌŁ¼ÓČėCO2(g)”¢H2(g)”¢CH3OH(g)”¢H2O(g)ø÷1mol£¬»ÆŃ§Ę½ŗā____________(Ģī”°ÕżĻņ”±”¢”°ÄęĻņ”±»ņ”°²»”±)ŅĘ¶Æ£®
¢ņ£ŗĄūÓĆCO2(g)+CH4(g) 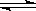 2CO(g)+2H2(g)½«CO2×Ŗ»Æ³ÉČ¼ĮĻĘų£®T”ꏱ£¬ŌŚŗćČŻĆܱÕČŻĘ÷ÖŠĶØČėĪļÖŹµÄĮæ¾łĪŖ0.1molµÄCH4ÓėCO2£¬·¢ÉśÉĻŹö·“Ó¦£¬²āµĆCH4µÄĘ½ŗā×Ŗ»ÆĀŹÓėĪĀ¶Č¼°Ń¹ĒæµÄ¹ŲĻµČēĶ¼ĖłŹ¾£¬
2CO(g)+2H2(g)½«CO2×Ŗ»Æ³ÉČ¼ĮĻĘų£®T”ꏱ£¬ŌŚŗćČŻĆܱÕČŻĘ÷ÖŠĶØČėĪļÖŹµÄĮæ¾łĪŖ0.1molµÄCH4ÓėCO2£¬·¢ÉśÉĻŹö·“Ó¦£¬²āµĆCH4µÄĘ½ŗā×Ŗ»ÆĀŹÓėĪĀ¶Č¼°Ń¹ĒæµÄ¹ŲĻµČēĶ¼ĖłŹ¾£¬
(5)ĻĀĮŠŹĀŹµÄÜĖµĆ÷øĆ·“Ó¦“ļµ½Ę½ŗāµÄŹĒ_______________
a£®COµÄĪļÖŹµÄĮæ²»ŌŁ·¢Éś±ä»Æ
b£®»ģŗĻĘųĢåµÄĆÜ¶Č²»ŌŁ·¢Éś±ä»Æ
c£®vÕż(CO2)=2vÄę(H2)
d£®»ģŗĻĘųĢåŃ¹Ēæ²»ŌŁ·¢Éś±ä»Æ
e£®µ„Ī»Ź±¼äÄŚÉś³Én mol CH4µÄĶ¬Ź±ĻūŗÄ2n mol H2
(6)¾ŻĶ¼æÉÖŖP1”¢P2”¢P3”¢P4ÓÉŠ”µ½“óµÄĖ³ŠņŹĒ__________________________£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğ½Ī÷Ź”ø߶žÉĻ10ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠÓŠ¹ŲŠšŹöÕżČ·µÄŹĒ( )
A£®²»ŠčŅŖ¼ÓČČ¾ĶÄÜ·¢ÉśµÄ·“Ó¦Ņ»¶ØŹĒ·ÅČČ·“Ó¦
B£®HF”¢Ca(OH)2”¢BaSO4¶¼ŹĒĒæµē½āÖŹ
C. ÉżøßĪĀ¶Č£¬æÉĶ¬Ź±Ģįøß»ī»Æ·Ö×Ó°Ł·ÖŹżŗĶ»ī»Æ·Ö×ÓÅØ¶Č£¬Ź¹»Æѧ·“Ó¦ĖŁĀŹ¼Óæģ
D. Na2O2ČÜÓŚĖ®£¬Éś³ÉNaOH£¬ĘäĖ®ČÜŅŗÄܵ¼µē£¬¹ŹNa2O2²»ŹĒµē½āÖŹ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
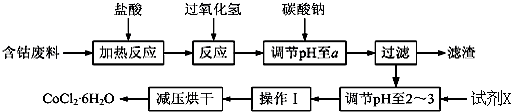
| ³ĮµķĪļ | Fe£ØOH£©3 | Fe£ØOH£©2 | Co£ØOH£©2 | Al£ØOH£©3 |
| æŖŹ¼³Įµķ | 2.3 | 7.5 | 7.6 | 3.4 |
| ĶźČ«³Įµķ | 4.1 | 9.7 | 9.2 | 5.2 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com