
【题目】下列物质属于电解质的是( )
A.CO2
B.C12H22O11(蔗糖)
C.BaSO4
D.NaOH溶液
科目:高中化学 来源: 题型:
【题目】右表为周期表的一部分,其中X、Y、W、Z为短周期元素,T单质常温下为液体。下列说法错误的是

A. X、Y是形成生命物质的重要元素
B. Y、Z元素氢化物的稳定性依次递增
C. 工业上电解NaW溶液得W2可使用阴离子交换膜
D. R可用于制造半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向AgCl饱和溶液中加水,下列叙述正确的是
A. AgCl 的溶解度、Ksp均不变 B. AgCl 的溶解度、Ksp均增大
C. AgCl的溶解度增大 D. AgCl 的Ksp增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从含Br-废水中提取Br2的过程,包括过滤、氧化、正十二烷萃取及蒸馏等步骤。已知:
Br2 | CCl4 | 正十二烷 | |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |

下列说法正确的是( )
A. 用甲装置过滤时,需不断搅拌
B. 用乙装置将Br-氧化为Br2
C. 丙装置中用正十二烷而不用CCl4,是因为其密度小
D. 可用装置丁进行蒸馏,先收集正十二烷再收集Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中含有CO、NO等有害气体。
(1)汽车尾气中NO生成过程的能量变化示意图如下:

该条件下,1mol N2和1molO2完全反应生成NO,会____(填“吸收”或“放出”)_____kJ能量。
(2)化学电池在通讯、交通及日常生活中有着广泛的应用。目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2。
2Ni(OH)2+Cd(OH)2。
①已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,放电就是使用电池的过程,充电是给电池补充电量的过程。以下说法中正确的是______。
A. 以上反应不属于置换反应 B.以上反应是可逆反应
C. 充电时化学能转变为电能 D.放电时化学能转变为电能
②写出负极的电极反应式________________________________________。
③废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍锡电池可以使一平方米面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重。这是因为____________。
(3)一种新型催化剂能使NO和CO发生反应:2NO+2CO![]() 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
实验编号 | t(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
Ⅱ | 280 | 1.20×10-3 | B | 124 |
Ⅲ | 350 | A | 5.80×10-3 | 82 |
①请把表中数据补充完整:A_______________;B_______________。
②能验证温度对化学反应速率影响规律的是实验______________(填实验序号)。
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如下图所示,其中表示实验Ⅱ的是曲线_________(填“甲”或“乙”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 弱酸酸式盐NaHB在水溶液中水解:HB–+H2O ![]() H3O++B2–
H3O++B2–
B. 硫化钠水解: S2- + 2H2O = H2S↑+2OH-
C. 碳酸钠溶液显碱性:CO32-+H2O ![]() HCO3-+OH-
HCO3-+OH-
D. 制备氢氧化铁胶体:Fe3+ +3H2O ![]() Fe(OH)3(胶体) + 3H+
Fe(OH)3(胶体) + 3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤和汽车尾气是造成空气污染产生雾霾的原因之一。消除汽车尾气是减少城市空气污染的热点研究课题。
(1)已知:①N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
②CO(g)+1/2 O2(g)=CO2 (g) △H=-283kJ·mol-1
则汽车尾气中NO和CO在催化转化器中相互反应成无污染的气体的热化学方程式是__________。
(2)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。

已知当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程的变化曲线_____________。
(3)在一定温度下,将2.0mol NO、2.4mol气体CO 通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如右图所示:

①有害气体NO的转化率为________, 0~15min NO的平均速率v(NO)=______mol/(L·min)。(保留两位有效数字)
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是________(选填序号)。
a.缩小容器体积b.增加CO的量 c.降低温度 d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将___________移动(选填“向左”、“向右”或“不”),移动后在达到平衡时的平衡常数的值是____________(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用物质的量浓度为0.100 0 mol·L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:

(1)用标准NaOH溶液滴定时,应将标准NaOH溶液注入_______(填“甲”或“乙”)中。
(2)某学生的操作步骤如下:
A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴部分充满溶液;
D.取标准NaOH溶液注入碱式滴定管至“0”刻度以上 2~3 mL;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是____→___→___→___→A→___(用字母序号填写)。判断到达滴定终点的实验现象是_____________________________________
(3)右上图是碱式滴定管中液面在滴定前后的读数, c(HCl)=_______ mol·L-1。
(4)由于错误操作,使得上述所测盐酸溶液的浓度偏高的是________(填字母)。
A.中和滴定达终点时俯视滴定管内液面读数
B.酸式滴定管用蒸馏水洗净后立即取用25.00 mL待测酸溶液注入锥形瓶进行滴定
C.碱式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.用酸式滴定管量取待测盐酸时,取液前有气泡,取液后无气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能量是国民经济发展的重要基础,天然气是我国目前使用的主要能源。
(1)已知
化学键 | C-H | C=O | O=O | H-O |
E/(KJ/mol) | a | b | c | d |
CH4(g)+2O2(g)=CO2(g)+2H2O(g)的焓变ΔH=______kJ/mol。
(2)燃料电池具有高的发电效率,因而受到重视。下图甲为甲烷燃料电池(电解质溶液为硫酸)该电池的正极反应为_________。
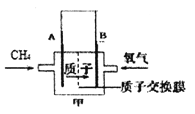
(3)利用上述燃料电池,按下图所示装置进行电解,A、B、C、D均为铂电极,
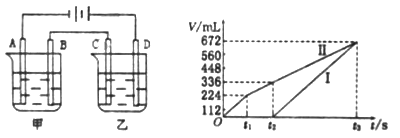
I.甲槽中有200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如上图所示(气体体积已换算成标准状况下的体积),(电解前后溶液的体积变化关系忽略不计)
①原混合溶液中NaCl的物质的量浓度__________mol/L。
②t2时所得溶液的pH=________。
Ⅱ.乙槽中为足量的AgNO3溶液。则阳极反应为__________。t3时电解结束,为了使溶液恢复原样,则可以在反应后的溶液中加入______(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com