
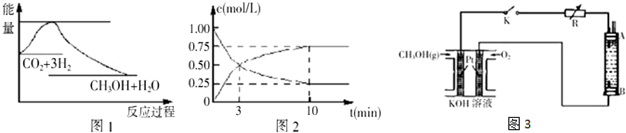
分析 (1)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,依据书写热化学方程式的方法写出该反应的热化学方程式;
(2)①根据反应速率v=$\frac{△c}{△t}$计算反应速率,转化率等于变化浓度和初始浓度的比值;
②相同条件下达到平衡时,混合物中各组分的物质的量与(1)中平衡相同,说明两平衡为完全等效平衡,(1)中转化率比(2)中的高,参加反应的氮气的物质的量较(2)多;
③能使H2的转化率提高的措施是促使化学平衡正向移动的措施,但是不能增加氢气的投料;
(3)燃料电池是原电电池装置,通入燃料CH3OH是负极,发生氧化反应,通入氧气的电极是正极,该电极上发生得电子的还原反应,电解法制取Fe(OH)2的阳极材料是金属铁,该电极上金属铁失电子发生氧化反应,在阴极上发生的反应是2H++2e-=H2↑,在阴极附近可以产生氢氧化亚铁沉淀,根据电极反应式进行计算.
解答 解:(1)25℃,1.01×105Pa时,16g 液态甲醇物质的量为0.5mol,完全燃烧,当恢复到原状态时,放出363.3kJ的热量,依据书写热化学方程式的方法写出该反应的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.6 kJ•mol-1;
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.6 kJ•mol-1.
(2)①在体积为lL的密闭容器中充入lmolCO2和4molH2,一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
初始浓度:1 4 0 0
变化浓度:0.75 2.25 0.75 0.75
平衡浓度:0.25 1.75 0.75 0.75
从反应开始到平衡,CH3OH的平均反应速率v(CH3OH)=$\frac{0.75mol/L}{10min}$=0.075mol/(L•min);H2的转化率为$\frac{2.25}{4}$×100%=56.25%,故答案为:0.075mol/(L•min));56.25%;
②相同条件下达到平衡时,混合物中各组分的物质的量与(1)中平衡相同,说明两平衡为完全等效平衡,平衡时氨气的物质的量相同,由于(2)中起始含有cmol NH3,故(2)中反应生成的氨气比(1)少,(1)中参加反应的氮气的物质的量较(2)多,所以放出的热量(1)>(2).
故答案为:大于;
③A.反应是放热的,升高温度,平衡逆向移动,所以氢气的转化率减小,故错误;
B.将CH3OH(g)及时液化抽出,平衡正向移动,所以氢气的转化率增大,故正确;
C.选择高效催化剂,能加快反应速率,但是不会引起化学平衡的移动,转化率不变,故错误;
D.相同条件下 再充入lmolCO2和4molH2相当于对平衡加压,所以反应物的转化率增加,故正确,故选BD;
(3)①燃料电池是原电电池装置,通入燃料CH3OH是负极,发生氧化反应,电极反应为:CH3OH+8OH--6e-=CO32-+6H2O;故答案为:CH3OH+8OH--6e-=CO32-+6H2O;
②A.电源中的负极附近发生反应:CH3OH+8OH--6e-=CO32-+6H2O,pH降低,故错误;
B.电极B和电源正极相连,是阳极,该电极上发生氧化反应,故正确;
C.电解法制取Fe(OH)2的阳极B材料是金属铁,该电极上金属铁失电子发生氧化反应,但是A电极不一定用金属铁,故错误;
D.阴极发生的反应是还原反应:2H++2e-=H2↑,该电极附近氢氧根离子浓度增加,产生氢氧化亚铁,故正确;
E.电解的电解质溶液不能是CuSO4溶液,这样的话在阴极上产生金属铜,发生的反应是金属铁置换铜的反应,不能得到氢氧化亚铁,故错误;
故选BD;
③若电池中甲醇的通入量为8g,且反应完全,根据负极反应:CH3OH+8OH--6e-=CO32-+6H2O,转移电子的物质的量是$\frac{8g}{32g/mol}$×6=1.5mol,根据Fe~2e-~Fe(OH)2,则理论上最多能产生Fe(OH)2沉淀质量:$\frac{1.5mol}{2}$×90g/mol=67.5g,故答案为:67.5.
点评 本题考查综合考查电极反应式的书写、计算、盖斯定律的应用和热化学方程式的书写、速率和平衡的计算等知识,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微量元素缺少或者摄入过多,都可能导致患各种代谢疾病 | |
| B. | 儿童缺锌可导致生长发育不良,抵抗力差,食欲不振 | |
| C. | 人体缺钙,可以多喝硬水补钙 | |
| D. | 缺铁性贫血,可通过食用铁强化酱油预防 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/K | 298 | 398 | 498 | … |
| 平衡常数(K) | 4.1×105 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水中加入少量ZnSO4固体时,水的电离平衡向正反应方向移动,Kw减小 | |
| B. | 在ZnSO4溶液中各离子的浓度关系为:2c(Zn2+)+c(H+)═c(OH-)+2c(SO42-) | |
| C. | 在0.5 L 0.10 mol•L-1的ZnSO4溶液中加入等体积的0.02 mol•L-1的AgNO3溶液,即可生成Ag2SO4沉淀 | |
| D. | 常温下,要除去0.20 mol•L-1 ZnSO4溶液中的Zn2+,至少要调节pH≥8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素、蔗糖和麦芽糖水解的最终产物都是葡萄糖 | |
| B. | 可以用Na2CO3溶液或者NaOH溶液除去乙酸乙酯中的乙酸和乙醇 | |
| C. | 天然油脂是混合物,主要成分是饱和和不饱和的高级脂肪酸 | |
| D. | 蛋白质溶液中加入Na2SO4可使其析出,再加水蛋白质又会重新溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com