
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
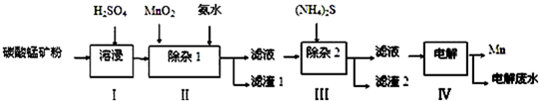
分析 向碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)中加入硫酸,可以发生反应生成硫酸盐,向其中就如具有氧化性的二氧化锰,可以将亚铁离子氧化为铁离子,调节pH可以将氢氧化铁沉淀下来,向滤液中加入硫化铵,可以将镍离子、钴离子形成硫化物沉淀下来,最后对得到的含有锰离子的盐电解,可以得到金属锰,
(1)加稀硫酸时样品中的MnCO3和硫酸反应生成可溶性的MnSO4,并产生二氧化碳和水;
(2)Mn2+离子易水解;
(3)据得失电子守恒有MnO2+2Fe2+--Mn2++2Fe3+,再据电荷守恒有MnO2+2Fe2++4H+--Mn2++2Fe3+,最后据原子守恒得MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(4)根据操作方法判断缺少的仪器;由于在第一次过滤之后的滤液中含有Mn2+、Ni2+、Co2+,向其中加入(NH4)2S,根据各物质的溶度积常数可确定有CoS和NiS沉淀(滤渣2)生成;
(5)由于将一级沉降根据MnS的Ksp=c(Mn2+)•c(S2-)进行计算即可.
解答 解:向碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)中加入硫酸,可以发生反应生成硫酸盐,向其中就如具有氧化性的二氧化锰,可以将亚铁离子氧化为铁离子,调节pH可以将氢氧化铁沉淀下来,向滤液中加入硫化铵,可以将镍离子、钴离子形成硫化物沉淀下来,最后对得到的含有锰离子的盐电解,可以得到金属锰,
(1)加稀硫酸时样品中的MnCO3和硫酸反应生成可溶性的MnSO4,并产生二氧化碳和水,步骤Ⅰ中,MnCO3与硫酸反应的化学方程式为:MnCO3+H2SO4=MnSO4+CO2↑+H2O,
故答案为:MnCO3+H2SO4=MnSO4+CO2↑+H2O;
(2)Mn2+离子易水解.加入过量硫酸,还可以抑制Mn2+的水解,
故答案为:抑制Mn2+的水解;
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式是据得失电子守恒有MnO2+2Fe2+-Mn2++2Fe3+,再据电荷守恒有MnO2+2Fe2++4H+-Mn2++2Fe3+,最后据原子守恒得,MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(4)步骤Ⅲ为过滤操作,需要用到的玻璃仪器除玻璃棒、漏斗外,还需要烧杯;
由于在第一次过滤之后的滤液中含有Mn2+、Ni2+、Co2+,向其中加入(NH4)2S,根据各物质的溶度积常数可确定有CoS和NiS沉淀(滤渣2)生成,
故答案为:烧杯;CoS和NiS;
(5)MnS的Ksp=c(Mn2+)•c(S2-)=1.0×10-11,为了将Mn2+降到1.0×10-5mol/L,则c(S2-)=$\frac{K{\;}_{sp}}{c(Mn{\;}^{2+})}$=$\frac{1.0×10{\;}^{-11}}{1.0×10{\;}^{-5}}$=1.0×10-6mol/L,即硫化钠的浓度是1.0×10-6mol/L,
故答案为:1.0×10-6.
点评 本题考查了制备方案的设计,题目难度中等,根据制备流程明确制备原理为解答关键,注意掌握难溶物溶解平衡及溶度积的有关计算方法,试题培养了学生的分析、理解能力及化学实验能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:推断题
 R可以被KMnO4的酸性溶液氧化生成
R可以被KMnO4的酸性溶液氧化生成 COOH,但若烷基R中直接与苯环连接的碳原子上没有C-H键,则不容易被氧化得到
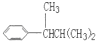
COOH,但若烷基R中直接与苯环连接的碳原子上没有C-H键,则不容易被氧化得到 COOH.现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成为
COOH.现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成为 COOH的异构体共有7种,其中的3种是:
COOH的异构体共有7种,其中的3种是: CH2CH2CH2CH2CH3,
CH2CH2CH2CH2CH3,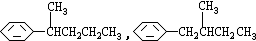
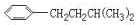 ,
,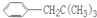 ,
, ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23gNa在氧气中完全燃烧失去NA个电子 | |
| B. | 常温常压下,6.2g Na2O含有的Na+离子数为0.2 NA | |
| C. | 标准状况下,22.4LH2O含有NA个分子 | |
| D. | 1L0.5 mol/LFe2(SO4)3溶液中,SO42-的数目为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
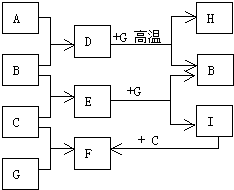 单质A、B、C在常温下均为气态,分别由甲、乙、丙三种短周期元素组成;丙元素的原子结构中次外层电子数比最外层电子数多1;G是常见的金属单质,D在常温下为液态,H是一种黑色晶体.各物质间的转化关系如图所示(反应条件多数已略去).
单质A、B、C在常温下均为气态,分别由甲、乙、丙三种短周期元素组成;丙元素的原子结构中次外层电子数比最外层电子数多1;G是常见的金属单质,D在常温下为液态,H是一种黑色晶体.各物质间的转化关系如图所示(反应条件多数已略去). ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.18 g | B. | 3.12 g | C. | 4.68 g | D. | 5.08 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com