
如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42﹣═2PbSO4+2H2O.下列有关说法正确的是

A.K与N相接时,能量由电能转化为化学能
B.K与N相接时,Pb上发生反应为:Pb-2e- = Pb2+
C.K与M连接时,所用电源的a极为负极
D.K与M连接时,PbO2上发生反应为:PbO2+4e_+4H++SO42﹣═PbSO4+2H2O
科目:高中化学 来源:2014-2015学年江西省高三上学期第六次考试理综化学试卷(解析版) 题型:选择题
下表是3种物质的溶解度(20 ℃),下列说法中正确的是
物质 | MgCl2 | Mg(OH)2 | MgCO3 |
溶解度(g/100 g) | 74 | 0.000 84 | 0.01 |
A.已知MgCO3的Ksp=6.82×10-6 mol2·L-2,则所有含有固体MgCO3的溶液中,都有
c(Mg2+)=c(CO32-),且c(Mg2+)·c(CO32-)=6.82×10-6 mol2·L-2
B.除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液
C.将表中三种物质与水混合,加热、灼烧,最终的固体产物相同
D.用石灰水处理含有Mg2+和HCO3-的硬水,发生的离子反应方程式为
Mg2++2HCO3-+Ca2++2OH-===CaCO3↓+MgCO3↓+2H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一上第二次月考化学试卷(解析版) 题型:选择题
铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH物质的量之比为
A.l:1 B.3:1 C.2:1 D.1:3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一上第二次月考化学试卷(解析版) 题型:实验题
铁做为重要的金属元素与人类生产生活密切相关,某课外活动小组在学习了氧化剂和还原剂后,要利用实验验证铁及其化合物的性质。
请你帮助他们完成以下实验报告:
(1)实验目的:探究铁及其化合物的氧化性和还原性
(2)试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片
(3)仪器:胶头滴管, (你认为本实验必不可少的一种玻璃仪器)。
(4)实验记录(虚线部分不必填写)
序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为棕黄色 | Fe2+具有还原性 | |
② | 在FeCl2溶液中加入锌片 | Zn+Fe2+=Zn2++Fe | ||
③ | 在FeCl3溶液中加入足量铁粉 | Fe+2Fe3+=3Fe2+ | Fe3+具有氧化性 | |
④ | 溶液由黄色变为蓝色 | Fe3+具有氧化性 |
(5)实验结论:Fe只有还原性,Fe3+只有氧化性,Fe2+既有氧化性,又有还原性。
①根据以上结论判断,下列物质中既有氧化性,又有还原性的有: (填序号)。
A Cl2 B Na C Na+ D Cl- E NO2
②亚铁盐在溶液中易被氧化,而实验室中需要纯净的亚铁盐溶液。那么保存亚铁盐溶液时应该加入少量 防止亚铁盐被氧化。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二上第三次月考化学试卷(解析版) 题型:选择题
下列实验能达到预期目的的是
编号 | 实验内容 | 实验目的 |
A | 室温下,用pH试纸分别测定浓度为0.1 mol·L-1 NaClO溶液和0.1 mol·L-1 CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
C | 向10 mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp:Mg(OH)2>Fe(OH)3 |
D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性S>C |
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上第四次月考化学试卷(解析版) 题型:选择题
下列晶体分类中正确的是一组是
离子晶体 | 原子晶体 | 分子晶体 | |
A | NaOH | Ar | SO2 |
B | H2SO4 | 石墨 | S |
C | CH3COONa | 水晶 |
|
D | Ba(OH)2 | 金刚石 | 玻璃 |
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上四次模拟化学卷(解析版) 题型:填空题
X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
X | Y | |
Z | W |
请回答下列问题:
(1)W位于周期表中第__________周期,第________族;
(2)X可形成双原子分子,其分子的电子式是___________;Y和氢元素形成的10电子微粒中常见的+1价阳离子为_________(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为__________;
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式______________________。
(4)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡进有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式是_____________。
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三上12月模拟化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.尽管NO2能与水反应生成硝酸,但 NO2不属于酸性氧化物
B.Na2O 溶于水所得溶液能导电,据此可判断 Na2O属于电解质
C.氨气和氯化氢气体混合后生成的NH4Cl是离子化合物,因此该反应为离子反应
D.某气体只含N、H 两种元素,且质量之比为14︰3,则该气体一定为纯净物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上学期12月月考化学试卷(解析版) 题型:填空题
某课题组研究以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺,其设计的流程如下:
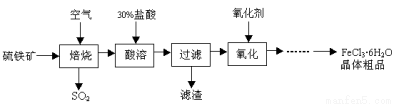
回答下列问题:
(1)已知在焙烧硫铁矿石过程中铁元素转化成了Fe3O4,则该反应的化学方程式是 ;
(2)“酸溶”中反应的离子方程式是 ;
(3)“过滤”后滤液中金属阳离子有 ;
(4)“氧化”中使用的氧化剂最好是 ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com