
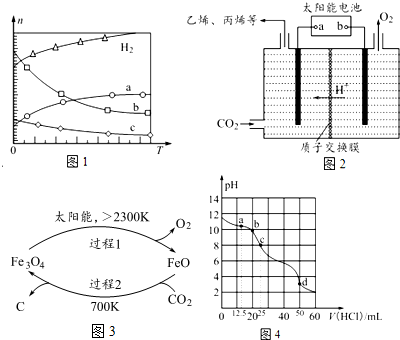
分析 (1)①由图可知,升高温度,氢气物质的量增大,说明平衡逆向移动,则正反应是放热反应;
②升高温度平衡逆向移动,a曲线随着温度升高,物质的量增大,为二氧化碳,b、c随着温度升高其物质的量降低,为生成物水、乙烯,但水的变化量大于乙烯;
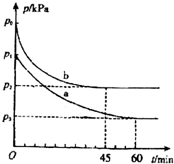
(2)①太阳能电池中光能转化为电能,电解强酸性的二氧化碳水溶液得到乙烯,电能转化为化学能;
②解时,二氧化碳在连接电源a极的电极上得电子发生还原反应生成乙烯,a为电源负极,b为电源的正极;
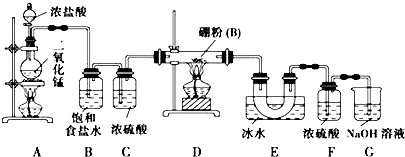
(3)①根据图知,Fe3O4在大于2300K时分解为FeO与O2;
②发生反应:6FeO(S)+CO2 2Fe3O4(S)+C,计算C的物质的量,根据C元素化合价变化计算转移电子;
2Fe3O4(S)+C,计算C的物质的量,根据C元素化合价变化计算转移电子;
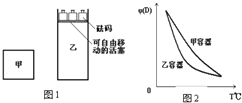
(4)A.a点n(HCl)=0.1000mol/L×0.0125L=0.00125mol,n(Na2CO3)=0.1000mol/L×0.025L=0.0025mol,反应生成0.00125molNaHCO3,剩余0.00125molNa2CO3,NaCl为0.00125mol,碳酸根离子水解程度大于碳酸氢根离子;
B.b点时n(HCl)=0.1mol/L×0.02L=0.002mol,n(Na2CO3)=0.1000mol/L×0.025L=0.0025mol,由物料守恒可知5c(Cl-)=4c(HCO3-)+4c(CO32-)+4c(H2CO3);
C.c点时n(HCl)=0.1mol/L×0.025L=0.0025mol,恰好完全反应生成NaHCO3,根据质子守恒得c(OH-)+c(CO32-)=c(H+)+c(H2CO3);
D.d点n(HCl)=0.1000mol/L×0.050L=0.005mol,为碳酸钠物质的量的二倍,二者反应方程式为 Na2CO3+2HCl=2NaCl+CO2+H2O,溶液中的溶质为NaCl,会溶解部分二氧化碳,根据质子恒等式可判断.
解答 解:(1)①由图可知,升高温度,氢气物质的量增大,说明平衡逆向移动,则正反应是放热反应,故△H<0,
故答案为:<;
②根据图知,升高温度,氢气物质的量增大,说明平衡逆向移动,则正反应是放热反应;a曲线随着温度升高,物质的量增大,为二氧化碳,b、c随着温度升高其物质的量降低,为生成物水、乙烯,但水的变化量大于乙烯,所以b曲线代表H2O,
故答案为:H2O;
(2)①太阳能电池中光能转化为电能,电解强酸性的二氧化碳水溶液得到乙烯,电能转化为化学能,
故答案为:太阳能转化为电能,电能转化为化学能;
②电解时,二氧化碳在连接电源a极的电极上得电子发生还原反应生成乙烯,a为电源负极,b为电源的正极,生成丙烯的电极反应式为2CO2+12H++12e-=C2H4+4H2O,
故答案为:正;2CO2+12H++12e-=C2H4+4H2O;
(3)①根据图知,Fe3O4在大于2300K时分解为FeO与O2,反应方程式为2Fe3O4 $\frac{\underline{\;>2300\;}}{\;}$ 6FeO+O2↑,
故答案为:2Fe3O4 $\frac{\underline{\;>2300\;}}{\;}$ 6FeO+O2↑;
②发生反应:6FeO(S)+CO2 2Fe3O4(S)+C,生成1mol Fe3O4时可以得到C的物质的量为0.5mol,转移电子为0.5mol×4=2mol,
2Fe3O4(S)+C,生成1mol Fe3O4时可以得到C的物质的量为0.5mol,转移电子为0.5mol×4=2mol,
故答案为:2mol;
(4)A.a点n(HCl)=0.1000mol/L×0.0125L=0.00125mol,n(Na2CO3)=0.1000mol/L×0.025L=0.0025mol,反应生成0.00125molNaHCO3,剩余0.00125molNa2CO3,NaCl为0.00125mol,碳酸根离子水解程度大于碳酸氢根离子,c(HCO3-)>c(Cl-)>c(CO32-),故A正确;
B.b点时n(HCl)=0.1mol/L×0.02L=0.002mol,n(Na2CO3)=0.1000mol/L×0.025L=0.0025mol,由物料守恒可知5c(Cl-)=4c(HCO3-)+4c(CO32-)+4c(H2CO3),则5c(Cl-)>4c(HCO3-)+4c(CO32-),故B正确;
C.c点时n(HCl)=0.1mol/L×0.025L=0.0025mol,恰好完全反应生成NaHCO3,根据质子守恒得c(OH-)+c(CO32-)=c(H+)+c(H2CO3),故C正确;
D.d点n(HCl)=0.1000mol/L×0.050L=0.005mol,为碳酸钠物质的量的二倍,二者反应方程式为 Na2CO3+2HCl=2NaCl+CO2+H2O,溶液中的溶质为NaCl,会溶解部分二氧化碳,根据质子恒等式可知,c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故D正确;
故选:ABCD.
点评 本题考查化学平衡图象、原电池和电解池原理、氧化还原反应有关计算、离子浓度大小比较等,(4)中关键是判断各点溶液中溶质,注意掌握物料守恒、电荷守恒、质子恒等式再离子浓度大小比较中应用,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | FeO | B. | Fe2O3 | C. | FeCl3 | D. | Fe3O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素相对原子质量依次递增 | |
| B. | 元素的最高正化合价呈周期性变化 | |
| C. | 元素原子最外层电子排布呈周期性变化 | |
| D. | 元素金属性或非金属性呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫及其化合物对人类的生产和生活有着重要的作用.
硫及其化合物对人类的生产和生活有着重要的作用.| 实验编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
| N(SO2) | N(NO2) | N(NO) | ||
| 甲 | T1 | 0.80 | 0.20 | 0.18 |
| 乙 | T2 | 0.20 | 0.80 | 0.16 |
| 丙 | T3 | 0.20 | 0.30 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠浮在液面上 | B. | 有无色无味的气体产生 | ||
| C. | 水溶液变为蓝色 | D. | 水溶液变为红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴离子的半径:Z>Y | |
| B. | 气态氢化物稳定性:Z>Y>X | |
| C. | 氧化物的水化物的酸性:Z>Y | |
| D. | 元素W、X、Z各自最高和最低化合价的代数和分别为0、2、6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定温度下,有可逆反应:2A(g)+2B(g)?C(g)+3D(g);△H<0.现将2molA和2mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图1).关于两容器中反应的说法正确的是( )
一定温度下,有可逆反应:2A(g)+2B(g)?C(g)+3D(g);△H<0.现将2molA和2mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图1).关于两容器中反应的说法正确的是( )| A. | 甲容器中的反应先达到化学平衡状态 | |
| B. | 两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成相同,混合气体的平均相对分子质量也相同 | |
| C. | 两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2所示 | |
| D. | 在甲容器中再充入2 mol A和2 mol B,平衡后甲中物质C的浓度和乙中物质C的浓度相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com