
某液态卤代烷RX(R是烷基,X是某种卤原子)的密度是a g•cm﹣3.RX可以与稀碱发生水解反应生成ROH(能跟水互溶)和HX.为了测定RX的相对分子质量,拟定的实验步骤如下:
①准确量取该卤代烷b mL,放入锥形瓶中.
②在锥形瓶中加入过量稀NaOH溶液,塞上带有长玻璃管的塞子,加热,发生反应.
③反应完成后,冷却溶液,加稀硝酸酸化,滴加过量AgNO3溶液得到白色沉淀.
④将沉淀过滤、洗涤、干燥后称重,得到固体c g.
回答下列问题:
(1)装置中长玻璃管的作用是 .
(2)该卤代烷中所含卤素的名称是 ,判断依据是 .
(3)如R为乙基,则RX与KOH醇溶液反应的方程式为:
(4)如果在步骤③中,加HNO3的量不足,没有将溶液酸化,则步骤④测得的c值
A.偏大 B.偏小 C.不变 D.大小不定.
| 测定有机物分子的元素组成. | |
| 专题: | 实验题. |
| 分析: | 本题涉及的实验原理是:RX+KOH→ROH+KX,KX+AgNO3=AgX↓+KNO3. (1)RX熔沸点较低,加热时易挥发,据此确定长导管的作用; (2)含有卤素原子的离子中,能和硝酸银反应生成白色沉淀的只能是氯离子,据此来回答判断; (3)卤代烃在强碱的醇溶液作用下会发生消去反应得到烯烃、氯化钠和水; (4)在溶液中,AgOH会转化为Ag2O沉淀,根据转化关系来计算回答. |
| 解答: | 解:(1)因RX熔沸点较低,加热时易挥发,所以装置中长导管的作用是防止卤代烃挥发或冷凝回流,故答案为:冷凝回流,提高原料利用率; (2)因为所得AgX沉淀为白色,能和硝酸银反应生成白色沉淀的只能是氯化银沉淀,所以卤代烃中含有氯元素,故答案为:氯;滴加过量AgNO3溶液,得白色沉淀; (3)R为乙基,则CH3CH2Cl与KOH醇溶液反应的方程式为:CH3CH2Cl+KOH (4)若加HNO3的量不足,未将溶液酸化,则沉淀中还有AgOH转化为Ag2O沉淀,由于氢氧化银和氧化银的影响,故测得的c值将偏大,故答案为:A. |
| 点评: | 本题考查有机物分子式的确定,难度中等,注意卤素离子的检验方法,属于综合知识的考查题. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
许多国家十分重视海水资源的综合利用,不需要化学变化就能够从海水中获得的物质是 ( )
A.氯、溴、碘 B.钠、镁、铝
C.烧碱、氢气 D.食盐、淡水
查看答案和解析>>
科目:高中化学 来源: 题型:
某氧化剂中,起氧化作用的是X2O72﹣,在溶液中0.2mol该离子恰好能使0.6mol SO32﹣离子完全氧化,则X2O72﹣离子被还原后的化合价为( )
|
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组有机物中,只需加入溴水就能一一鉴别的是( )
|
| A. | 己烯、苯、四氯化碳 | B. | 苯、己炔、己烯 |
|
| C. | 己烷、苯、环己烷 | D. | 甲苯、己烷、己烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的乙醇在氧气不足的情况下燃烧,得到CO2、CO和 H2O的总质量为27.6g,其中H2O的质量为10.8g,则CO的质量是( )
|
| A. | 1.4 g | B. | 2.2 g |
|
| C. | 4.4 g | D. | 在2.2 g和4.4 g之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知胆矾失水的化学反应方程式为:CuSO4•5H2O(s)=CuSO4(s)+5H2O(l);△H=+Q1kJ/mol
(2)室温下,无水硫酸铜溶于水的热化学方程式为:
CuSO4(s)=Cu2+(aq)+SO42﹣(aq);△H=﹣Q2kJ/mol
(3)胆矾溶于水时,溶液温度降低.Q1与Q2的关系是(Q1、Q2为正数)( )
|
| A. | Q1>Q2 | B. | Q1=Q2 | C. | Q1<Q2 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
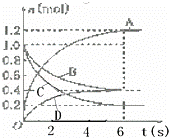
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
|
| A. | 该反应的化学方程式为3B+4D⇌6A+2C |
|
| B. | 反应进行到1 s时,v(A)=v(D) |
|
| C. | 反应进行到6 s时,B的平均反应速率为0.05 mol/(L•s) |
|
| D. | 反应进行到6 s时,各物质的反应速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家一直致力于“人工固氮”的新方法研究.
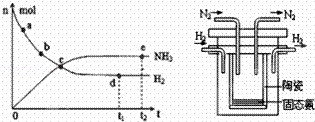
(1)目前合成氨技术原理为:N2(g)+3H2(g)⇌2NH3(g);△H=﹣92.4kJ•mol﹣1.
①673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如右图所示.下列叙述正确的是 .
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d和点 e处的n(N2)相同
D.773K,30MPa下,反应至t2时刻达到平衡,则n(NH3)比图中e点的值大
(2)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的 SCY陶瓷(能传递H+),实现了高温常压下高转化率的电解合成氨.其实验装置如图,阴极的电极反应式 .
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(1)⇌2NH3(g)+ O2(g)△H=a kJ•mol﹣1
O2(g)△H=a kJ•mol﹣1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K | 303 | 313 | 323:] |
| NH3生成量/(10﹣6mol) | 4.8 | 5.9 | 6.0 |
①此合成反应的a 0;△S 0(填“>”、“<”或“=”);该反应属于
A.一定自发 B.一定不自发 C.高温自发 D.低温自发
②已知:N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4kJ•mol﹣1
2H2(g)+O2(g)=2H2O(l)=﹣571.6kJ•mol﹣1则N2(g)+3H2O(1)=2NH3(g)+ O2(g)△H= kJ•mol﹣1.
O2(g)△H= kJ•mol﹣1.
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原滴定实验与中和滴定原理相似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液,或反之).现用0.1mol•L﹣1酸性KMnO4溶液(标准液)滴定未知浓度的H2O2水溶液(待测液),反应离子方程式是:2MnO4﹣+5H2O2+6H+=2Mn2++5O2↑+8H2O,请回答下列问题:
(1)该滴定实验一定不需要用到的仪器有下列中的 (填字母).
A、酸式滴定管(50mL) B、碱式滴定管(50mL) C、白纸 D、锥形瓶E、铁架台 F、滴定管夹 G、量筒(10mL)
(2)滴定时是否需要添加指示剂 ,理由 .
(3)实验中取H2O2溶液V mL,滴定前后滴定管液面刻度分别为a mL和b mL,则H2O2浓度为 .
(4)在滴定过程中,下列操作会使过氧化氢溶液测定浓度比实际浓度偏高的是 .
①盛装标准液的滴定管用蒸馏水洗净后未用标准液润洗
②锥形瓶中有少量蒸馏水,实验时没有烘干处理
③读数时,滴定前平视,滴定后俯视.
④滴定前盛装标准液的滴定管尖端气泡未排除,滴定后气泡消失
A.②③B.①④C.①③D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com