
| A. | 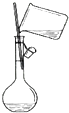 向容量瓶中转移液体 | B. | 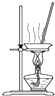 蒸干NH4Cl饱和溶液制备NH4Cl晶体 | ||
| C. | 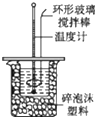 中和热的测定 | D. | 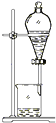 分离四氯化碳和水 |
分析 A.向容量瓶中转移液态时,需要用玻璃杯引流,玻璃杯下端放在容量瓶刻度线下方;
B.加热时氯化铵分解生成氨气和氯化氢;
C.根据测定中和热原理及正确的操作方法分析;
D.互不相溶的液体采用分液方法分离.
解答 解:A.配制一定物质的量浓度的溶液时,需要通过玻璃杯引流将液态转移到容量瓶中,玻璃杯下端放在容量瓶的刻度线下方,图示装置合理,故A不选;
B.加热时氯化铵分解生成氨气和氯化氢,所以蒸干氯化铵溶液得不到氯化铵晶体,故B选;
C.测定中和热时,需要用泡沫塑料保温隔热,两个烧杯口相平,用环形玻璃棒搅拌,图示装置能够完成中和热的测定,故C不选;
D.四氯化碳不溶于水,可以采用分液方法分离,故D不选;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及溶液配制、晶体制备、中和热的测定、物质分离和提纯等知识点,明确实验原理及物质性质差异性是解本题关键,注意从实验操作规范性、物质性质方面分析评价,易错选项是B.


科目:高中化学 来源: 题型:选择题
| A. | 涂油漆 | |
| B. | 海轮在海洋上航行,为防止船体腐蚀,常在船体上镶上铜块 | |
| C. | 在金属表面进行电镀 | |
| D. | 改变金属内部结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性溶液中:Rb+、Cs+、CH3COO-、Br- | B. | 饱和溴水中 I-、NO3-、Na+、SO32- | ||
| C. | D+、Cl-、NO3-、SiO32- | D. | Ag+、Fe3+、Br-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1735Cl与1737Cl得电子能力相同 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| D. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 共价键 | H2分子 | N2分子 | NH3分子 |
| 键能(KJ•mo1-1) | 436 | 945 | 391 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
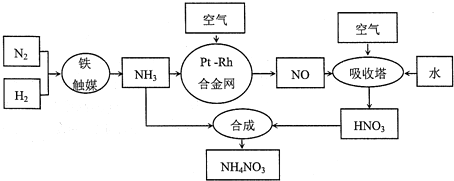
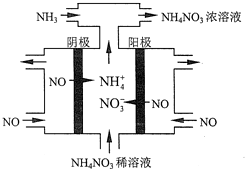
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
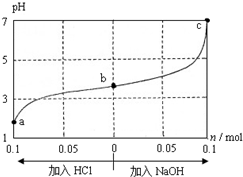
| A. | a、b、c 对应的混合液中,水的电离程度由大到小的顺序的是a>b>c | |
| B. | c点混合液中c(Na+)>c(CH3COO-) | |
| C. | 加入NaOH过程中,$\frac{c(N{a}^{+})×c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$减小 | |
| D. | 若忽略体积变化,则25℃时CH3COOH的电离平衡常数 K=$\frac{0.2}{w-0.2}$×10-7 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com