


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
| A、①②③ | B、②④⑤ |
| C、②③ | D、①⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、向CaCl2溶液中通入CO2至过量 |
| B、向澄清石灰水中通入CO2至过量 |
| C、向Na2SiO3溶液中通入CO2至过量 |
| D、AlCl3溶液滴加NaOH溶液至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H1>△H3>△H2=-57.3 kJ?mol-1 |
| B、△H2<△H1=-57.3 kJ?mol-1<△H3 |
| C、△H1>△H3=-57.3 kJ?mol-1>△H2 |
| D、△H1<△H3=-57.3 kJ?mol-1<△H2 |
查看答案和解析>>
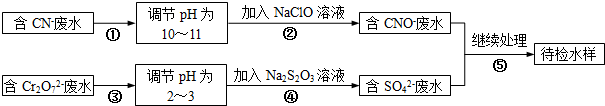
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |
| 实验步骤 | 实验结论 |
| ①氯水+1mLCCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、 |
| ②NaBr溶液+氯水+1mLCCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液++氯水+1mLCCl4,振荡,静置,观察四氯化碳层颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化镁、氧化铝的熔点都很高,都可用作耐高温材料 |
| B、二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| C、品红溶液通入二氧化硫,品红褪色,再加热不恢复红色 |
| D、锌的金属活泼性比铁强,可在海轮外壳上装若干锌块以减缓其腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
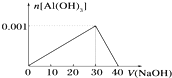
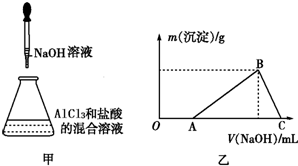
| A、AlCl3溶液的浓度为0.1mol?L-1 |
| B、NaOH溶液的浓度为0.1mol?L-1 |
| C、沉淀最大质量为0.078g |
| D、加入10mL的NaOH溶液与加入38mL的NaOH溶液产生的沉淀质量相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com