
| A、溶液、胶体和悬浊液这三种分散系的本质区别是能否透过滤纸或半透膜 |
| B、仅用新制的氢氧化铜悬浊液一种试剂可鉴别乙醇、甘油、乙醛、乙酸、乙酸乙酯、葡萄糖溶液(必要时可加热) |
C、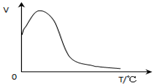 过氧化氢在酶催化作用下的分解反应速率随温度的变化关系如图所示 |
| D、工业上从海带中提取碘单质,经历的步骤有浸泡-过滤-氧化-结晶-粗碘提纯 |


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
| A、明矾能在水中生成Al(OH)3胶体,可用作净水剂 |
| B、FeCl3溶液能与Cu反应,可用于蚀刻印刷电路 |
| C、Na很容易失去电子,常用作还原剂 |
| D、Fe有较强的导电性,常用作导线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1(b-2a)mol/L |
| B、10(b-2a)mol/L |
| C、10(2a-b)mol/L |
| D、4(b-2a)mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温、常压下,16 g O3中含有的氧原子数为NA |
| B、7.8 g Na2O2与水充分反应,转移的电子数为0.2 NA |
| C、0.1 mol Fe与0.1 mol Cl2充分反应,转移的电子数为0.3NA |
| D、标准状况下,11.2 L H2O中含有的氢原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属Fe与稀H2SO4反应:Fe+2H+═Fe3++H2↑ |
| B、Al(OH)3治疗胃酸过多:H++OH-═H2O |
| C、NaHCO3溶液与NaOH溶液混合:HCO3-+OH-═H2O+CO2↑ |
| D、Al与NaOH溶液反应:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱电解质 | 电离平衡常数(Ka或 Kb) |
| CH3COOH | 1.8×10-5 |
| NH3?H2O | 1.8×10-5 |
| 难溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1.1×10-10 |
| BaCO3 | 2.6×10-9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com