
ĪŅ¹śŹĒøöøÖĢś“ó¹ś,øÖĢś²śĮæ¾ÓŹĄ½ēµŚŅ»Ī»,øßĀÆĮ¶ĢśŹĒ×īĪŖĘÕ±éµÄĮ¶Ģś·½·Ø”£Ä³ÖÖæóŹÆÖŠĢśŌŖĖŲŅŌŃõ»ÆĪļFemOnµÄŠĪŹ½“ęŌŚ,ĻÖ½ųŠŠČēĻĀŹµŃé:½«ÉŁĮæĢśæóŹÆѳʷ·ŪĖé,³ĘČ”25.0 gѳʷӌÉÕ±ÖŠ,¼ÓČėĻ”ĮņĖį³ä·ÖČܽā,²¢²»¶Ļ¼ÓČČ”¢½Į°č,ĀĖČ„²»ČÜĪļ”£ĻņĖłµĆĀĖŅŗÖŠ¼ÓČė10.0 gĶ·Ū³ä·Ö·“Ó¦ŗó¹żĀĖ”¢Ļ“µÓ”¢øÉŌļµĆŹ£Óą¹ĢĢå3.6 g”£Ź£ĻĀĀĖŅŗÓĆ2 mol”¤L-1µÄĖįŠŌKMnO4µĪ¶Ø,ÖĮÖÕµćŹ±ĻūŗÄKMnO4ČÜŅŗĢå»ż25.0 mL”£
(1)¼ĘĖćøĆĢśæóŹÆÖŠĢśŌŖĖŲµÄÖŹĮæ·ÖŹż”£
(2)¼ĘĖćŃõ»ÆĪļFemOnµÄ»ÆѧŹ½(m”¢nĪŖÕżÕūŹż)”£
(1)56%””(2)Fe5O7
”¾½āĪö”æ(1)ŅĄ¾Ż8H++Mn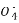 +5Fe2+
+5Fe2+ Mn2++5Fe3++4H2OæÉÖŖn(Fe2+)=5n(Mn
Mn2++5Fe3++4H2OæÉÖŖn(Fe2+)=5n(Mn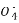 )=5”Į0.025 L”Į2 mol”¤L-1=0.25 mol,m(Fe)=14 g,ĢśæóŹÆÖŠĢśŌŖĖŲµÄÖŹĮæ·ÖŹż=
)=5”Į0.025 L”Į2 mol”¤L-1=0.25 mol,m(Fe)=14 g,ĢśæóŹÆÖŠĢśŌŖĖŲµÄÖŹĮæ·ÖŹż=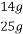 ”Į100%=56%;(2)²Ī¼Ó·“Ó¦n(Cu)=
”Į100%=56%;(2)²Ī¼Ó·“Ó¦n(Cu)=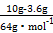 =0.1 mol,ŅĄ¾Ż2Fe3++Cu
=0.1 mol,ŅĄ¾Ż2Fe3++Cu 2Fe2++Cu2+æÉÖŖĢśæóŹÆÖŠn(Fe3+)=0.2 mol”¢n(Fe2+)=0.25 mol-0.2 mol=0.05 mol,1øöøĆŃõ»ÆĪļ·Ö×Óŗ¬ÓŠŅ»øö+2¼ŪĢśŌ×Ó,ŗ¬ÓŠ4øö+3¼ŪĢśŌ×Ó,ŅĄ¾Ż»ÆŗĻ¼ŪæÉÖŖOŌ×ÓĪŖ7øö
2Fe2++Cu2+æÉÖŖĢśæóŹÆÖŠn(Fe3+)=0.2 mol”¢n(Fe2+)=0.25 mol-0.2 mol=0.05 mol,1øöøĆŃõ»ÆĪļ·Ö×Óŗ¬ÓŠŅ»øö+2¼ŪĢśŌ×Ó,ŗ¬ÓŠ4øö+3¼ŪĢśŌ×Ó,ŅĄ¾Ż»ÆŗĻ¼ŪæÉÖŖOŌ×ÓĪŖ7øö


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
| 3 |
| 2 |
| 1 |
| 3 |
| 2 |
| 3 |
| ČŻĘ÷ | ·“Ó¦ĪļĶ¶ČėµÄĮæ | ·“Ó¦ĪļµÄ×Ŗ»ÆĀŹ | CH3OHµÄÅØ¶Č | ÄÜĮæ±ä»Æ £ØQ1£¬Q2£¬Q3¾ł“óÓŚ0£© |
| ¼× | 1mol COŗĶ2mol H2 | a1 | c1 | ·Å³öQ1kJČČĮæ |
| ŅŅ | 1mol CH3OH | a2 | c2 | ĪüŹÕQ2kJČČĮæ |
| ±ū | 2mol COŗĶ4mol H2 | a3 | c3 | ·Å³öQ3kJČČĮæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2012ÄźĖÕ½Ģ°ęøßÖŠ»ÆѧєŠŽ2 5.4 »ÆŃ§Å©Ņ©µÄ·¢Õ¹Į·Ļ°¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
ĪŅ¹śŹĒøöÅ©Ņµ“ó¹ś£¬Å©ŅµŹĒĮ¢¹śÖ®±¾£¬”°Å©“唢ũŅµ”¢Å©Ćń”±ŹĒµ³ÖŠŃėŠĀŹ±ĘŚÅ©“幤×÷µÄÖŲŠÄ£¬»Æ·ŹÓėÅ©Ņ©µÄ·¢Õ¹Ęš×žŽ“óµÄĶʶÆ×÷ÓĆ£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)Å©×÷ĪļÉś³¤¹ż³ĢÖŠ²»æÉȱɣµÄĪ¢ĮæŌŖĖŲÓŠFe”¢Mn”¢B”¢Cu”¢MoµČ£¬ĖüĆĒ»ņŹĒĆøµÄ×é³É³É·Ö£¬»ņÄÜĢįøßĆøµÄ»īŠŌ£¬ŹĒÅ©×÷ĪļĢåÄŚÓŖŃųĪļÖŹµÄŠĪ³ÉŗĶŠĀ³Ā“śŠ»²»æÉȱɣµÄ”£³£ÓĆĶ·ŹŹĒµØ·Æ£¬ŌŚŃĪ¼īµŲ(ĶĮČĄpH>7)Ź©ÓĆµØ·ÆŹ±ŅĖ½«ČÜŅŗ________(Ģī”°ÅēŌŚŅ¶Ę¬ÉĻ”±»ņ”°ĖęĖ®¹ąČėĶĮČĄÖŠ”±)£¬Ö÷ŅŖĄķÓÉŹĒ_______________________________________________________
________________________________________________________________________ӣ
(2)Å©Ņ©²Ø¶ū¶ąŅŗŹĒŅ»ÖÖ³£ÓƵÄɱ¾ś¼Į£¬³£ÓĆÅä·½ĪŖµØ·Æ”¢ÉśŹÆ»Ņ”¢Ė®£¬°“ÖŹĮæ±Č1”Ć0.56”Ć100»ģŗĻ£¬·ÖĪöĘä·ĄÖĪ²”³ęŗ¦µÄŌŅņ________________________________________”£
(3)Äā³ż³ę¾Õõ„ŹĒŅ»ÖÖøߊ§”¢µĶ¶¾£¬¶ŌĄ„³ęÓŠĒæĮŅ“„ɱ×÷ÓƵÄɱ³ę¼Į£¬ĘäÖŠ¶Ō¹āĪČ¶ØµÄäåĒč¾Õõ„µÄ½į¹¹¼ņŹ½ČēĶ¼£ŗ

Ęä·Ö×ÓŹ½ĪŖ________________________£¬ŌņĻĀĮŠ¶ŌøĆ»ÆŗĻĪļµÄŠšŹöÕżČ·µÄŹĒ________(Ģī×ÖÄø“śŗÅ)”£
A£®øĆ»ÆŗĻĪļŹōÓŚ·¼ĻćĢž
B£®øĆ»ÆŗĻĪļŹōÓŚĀ±“śĢž
C£®øĆ»ÆŗĻĪļŌŚ¼īŠŌĢõ¼žĻĀŹ§Č„Ņ©Š§
D£®øĆ»ÆŗĻĪļŌŚŅ»¶ØĢõ¼žĻĀæÉ·¢Éś¼Ó³É·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015½ģ¼ŖĮÖŹ”øßŅ»11ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗ¼ĘĖćĢā
ĪŅ¹śŹĒøöøÖĢś“ó¹ś£¬øÖĢś²śĮæĪŖŹĄ½ēµŚŅ»£¬øßĀÆĮ¶ĢśŹĒ×īĪŖĘÕ±éµÄĮ¶Ģś·½·Ø”£Ä³ÖÖæóŹÆÖŠĢśŌŖĖŲŅŌŃõ»ÆĪļFemOnµÄŠĪŹ½“ęŌŚ£¬ĻÖ½ųŠŠČēĻĀŹµŃé£ŗ½«ÉŁĮæĢśæóŹÆѳʷ·ŪĖ飬³ĘČ”25.0gѳʷӌÉÕ±ÖŠ£¬¼ÓČėĻ”ĮņĖį³ä·ÖČܽā£¬²¢²»¶Ļ¼ÓČČ”¢½Į°č£¬ĀĖČ„²»ČÜĪļ”£ĻņĖłµĆĀĖŅŗÖŠ¼ÓČė10.0gĶ·Ū³ä·Ö·“Ó¦ŗó¹żĀĖ”¢Ļ“µÓ”¢øÉŌļµĆŹ£Óą¹ĢĢå3.6g”£Ź£ĻĀĀĖŅŗÓĆÅضČĪŖ2mol”¤L-1µÄĖįŠŌKMnO4µĪ¶Ø£¬ÖĮÖÕµćŹ±ĻūŗÄKMnO4ČÜŅŗĢå»ż25.0mL”£
ĢįŹ¾£ŗ2Fe3+£«Cu === 2Fe2+£«Cu2+ 8H+£«MnO4-£«5Fe2+ === Mn2+£«5Fe3+£«4H2O
£Ø1£©¼ĘĖćøĆĢśæóŹÆÖŠĢśŌŖĖŲµÄÖŹĮæ·ÖŹż”£
£Ø2£©¼ĘĖćŃõ»ÆĪļFemOnµÄ»ÆѧŹ½£Øm”¢nĪŖÕżÕūŹż£©”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com